时间:2021-02-18 06:59:33
1、选择题 一定温度下,用水稀释c mol·L-1的稀醋酸,若用Kw表示水的离子积,则下列数值随水量的增加而增大的是
A.c(H+)/c(OH-)
B.c(CH3COOH)/c(H+)
C.c(CH3COO-)/c(CH3COOH)
D.c(H+)/KW
参考答案:C
本题解析:用水稀释稀醋酸过程中,醋酸电离平衡向电离的方向移动,醋酸的电离度增大,酸性减弱,水的电离平衡向电离的方向移动,A、c(H+)/c(OH-) 减小;B、c(CH3COOH)/c(H+)减小; C、c(CH3COO-)/c(CH3COOH) 增大;D、c(H+)/KW减小。答案选C。
考点:弱电解质的电离平衡
本题难度:一般
2、选择题 下列叙述中,不正确的是( )
A.0.1?mol?L-1CH3COOH溶液加水稀释,n(H+)增大
B.0.2?mol?L-1盐酸与等体积0.05?mol?L-1Ba(OH)2溶液混合后,溶液pH为1
C.向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度大于AgI
D.若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3)
参考答案:A、0.1?mol?L-1CH3COOH溶液加水稀释促进弱电解质醋酸的电离,离子浓度减少.n(H+)物质的量增加,故A正确;
B、0.2?mol?L-1盐酸中的氢离子浓度为0.2mol/L,0.05?mol?L-1Ba(OH)2溶液中氢氧根离子浓度为0.1mol/L,等体积混合按照H++OH-=H2O反应后,剩余氢离子浓度=0.2-0.12=0.05mol/L,pH>1,故B错误;
C、依据反应向更难的方向进行,向AgCl悬浊液中滴入KI溶液,生成AgI沉淀,说明AgCl的溶解度大于AgI,故C正确;
D、NH4HCO3溶液中的碳酸氢根离子水解促进铵根水解、NH4HSO4溶液中的氢离子抑制铵根离子的水解,NH4NO3溶液中只存在铵根离子的水解,若NH4HCO3溶液、NH4HSO4溶液和NH4NO3溶液中c(NH4+)相等,则需要溶质的浓度为c(NH4HSO4)<c(NH4NO3)<c(NH4HCO3),故D正确;
故选B.
本题解析:
本题难度:一般
3、选择题 下列关于强、弱电解质的叙述正确的是
?
A.强酸、强碱及大部分盐类属于强电解质,弱酸、弱碱属于弱电解质
?
B.所有的离子化合物都是强电解质,所有的共价化合物都是弱电解质
?
C.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
?
D.SO2的水溶液能导电,所以SO2是电解质
参考答案:A
本题解析:略
本题难度:一般
4、填空题 (9分)4种短周期元素相对位置如下表。M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素。回答下列问题: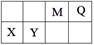
(1)X的原子结构示意图为 。
(2)0.1 molQ的10电子氢化物与CuO反应生成Cu2O、H2O和Q单质时,生成Cu2O的物质的量是 。
(3)Y的氧化物与NaOH溶液反应的化学方程式是 。
(4)HR是含M元素的一元酸。常温下,0.1 mol·L-1 HR 溶液中,c(H+) =1.3×10-3 mol·L-1。则HR H++R-的电离平衡常数Ka= (保留一位小数)。
H++R-的电离平衡常数Ka= (保留一位小数)。
参考答案:(9分)
(1) (2分) (2)0.15mol(2分)
(2分) (2)0.15mol(2分)
(3)Al2O3+2NaOH+3H2O=2Na[Al(OH)4](3分) (4)1.7×10-5(2分)
本题解析:M元素既是构成生物体的基本元素,又是构成地壳中岩石和化石燃料的主要元素,则M为C元素、Q为N元素、X为Mg元素、Y为Al元素。
(1)X为Mg元素,则X的原子结构示意图为: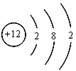
(2)Q的10电子氢化物为NH3,根据氧化还原反应中得失电子数相等可得对应关系:2NH3~3Cu2O,所以n(Cu2O)=3/2n(NH3)=3/2×0.1mol=0.15mol。
(3)Y的氧化物为Al2O3,属于两性氧化物,与NaOH溶液反应的化学方程式为:Al2O3+2NaOH+3H2O=2Na[Al(OH)4]。
(4)HR溶液中,H2O电离出的H+浓度非常小,可以忽略,所以HR电离平衡常数Ka=c(R-)?c(H+)/c(HR)= 1.3×10-3 ×1.3×10-3 /0.1=1.7×10-5。
考点:本题考查原子结构、元素周期律、氧化还原反应的计算、电离常数的计算。
本题难度:一般
5、选择题 不能用于判断HA是弱电解质(弱酸)的依据是(? )
A.浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
B.pH相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl多
C.浓度相等的HCl与HA两溶液,c(H+)HCl约是c(H+)HA的100倍
D.pH相等的HCl与HA两溶液,c(HA)约是c(HCl)的100倍
参考答案:A
本题解析:HCl与HA都是一元酸,HCl是强酸。无论HA是强酸还是弱酸,若浓度相等的HCl与HA两溶液体积相同时,跟镁反应生成氢气HA比HCl都一样多。错误。B.pH相等的HCl与HA两溶液,则c(H+)相同。当它们体积相同时,n(H+)相同。二者跟镁反应生成氢气HA比HCl多,说明HA能够产生的n(H+)。则HA为弱酸。当反应消耗H+后,HA H++A-正向移动,产生更多的H+。因此放出的氢气不HCl多。正确。C.HCl与HA都是一元酸。HCl是强酸。若HA是强酸,则当浓度相等的HCl与HA两溶液,c(H+)HCl=,c(H+)HA。若c(H+)HCl约是c(H+)HA的100倍,则c(H+)HA是c(H+)HCl的100分之一。因此证明HA为弱酸。正确。D.若HA是强酸, pH相等的HCl与HA两溶液,c(HA)= c(HCl).=10-pH。若c(HA)约是c(HCl)的100倍,则证明HA只有一部分发生电离。因此HA是弱酸。正确。
H++A-正向移动,产生更多的H+。因此放出的氢气不HCl多。正确。C.HCl与HA都是一元酸。HCl是强酸。若HA是强酸,则当浓度相等的HCl与HA两溶液,c(H+)HCl=,c(H+)HA。若c(H+)HCl约是c(H+)HA的100倍,则c(H+)HA是c(H+)HCl的100分之一。因此证明HA为弱酸。正确。D.若HA是强酸, pH相等的HCl与HA两溶液,c(HA)= c(HCl).=10-pH。若c(HA)约是c(HCl)的100倍,则证明HA只有一部分发生电离。因此HA是弱酸。正确。
本题难度:一般