时间:2021-02-18 06:53:14
1、选择题 下列反应中,既有共价键的断裂,又有离子键的形成的是( )
A.盐酸和氢氧化钠溶液反应
B.氯化氢气体溶解于水
C.氯化氢气体遇到氨气产生“白烟”
D.锌片投入稀硫酸中产生气体
参考答案:C ?
本题解析:溶于水的过程中,离子键会断裂,在溶液中进行的反应,无离子键的形成。
本题难度:一般
2、填空题 已知反应:2H2+O2 = 2H2O+能量,请填写下列表格中空白处的总能量值,并注明消耗还是放出。有关键能:H-H:436 kJ/mol ?O-O:496 kJ/mol? H-O:463 kJ/mol 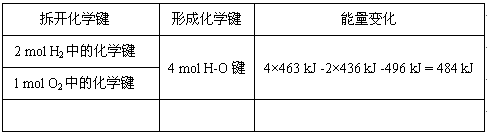
参考答案:共消耗1368kJ;共释放1852kJ;放热484KJ
本题解析:
本题难度:一般
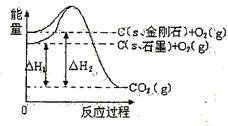
3、选择题 如图所示,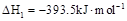 ,
,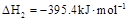 ,
,
下列说法或表示正确的是
A.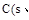 石墨)=
石墨)=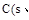 金刚石)△H=+1.9
金刚石)△H=+1.9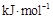
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性比金刚石弱
D.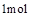 石墨的总键能比1mol金刚石的总键能小1.9kJ
石墨的总键能比1mol金刚石的总键能小1.9kJ
参考答案:A
本题解析:A、分析题给图像知,1mol石墨具有的能量比1mol金刚石具有的能量低1.9KJ,故C(s、石墨)= C(s、金刚石)△H=+1.9KJ·mol—1,正确;B、石墨和金刚石是不同的物质,石墨和金刚石的转化是化学变化,错误;C、石墨转化为金刚石为吸热反应,石墨的能量比金刚石的能量低,石墨的稳定性比金刚石强,错误;D、石墨转化为金刚石为吸热反应,1mol石墨的总键能比1mol金刚石的总键能大1.9kJ,错误。
考点:考查化学反应中的能量变化。
本题难度:一般
4、选择题 以下各微粒中,所有原子都满足最外层为8电子结构的是
A.NCl3
B. BF3
C. PCl5
D.H3O+
参考答案:A
本题解析:只要共价化合物分子中元素化合价的绝对值和该元素最外层电子数之和满足8,则元素就能满足最外层为8电子结构,据此可知选项B中的B元素、C中的P元素、D中的氢元素都不能满足最外层为8电子结构,A正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。该题的关键是明确8电子稳定结构的判断依据,然后结合题意和化学式灵活运用即可,有利于培养学生的逻辑推理能力和发散思维能力。
本题难度:一般
5、选择题 下列离子方程式书写正确的是
A.钠与水反应:Na+H2O═Na++OH-+H2↑
B.铁与硫酸铁溶液反应:Fe+Fe3+═2Fe2+
C.氢氧化镁与稀盐酸反应:Mg(OH)2+2H+═Mg2++2H2O
D.碳酸氢钠溶液中滴入氢氧化钠溶液:OH-+HCO3-═H2O+CO2↑
参考答案:C
本题解析:分析:A、根据电子守恒判断,该离子方程式中电子不守恒;
B、该离子方程式两边电荷不守恒;
C、注意氢氧化镁是难溶物,应该写成化学式;
D、生成碳酸根离子,不会生成二氧化碳气体.
解答:A、方程式两边电子不守恒,正确的应该是:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B、离子方程式两边电荷不守恒.正确的离子方程式是:Fe+2Fe3+═3Fe2+,故B错误;
C、氢氧化镁和盐酸反应的离子方程式::Mg(OH)2+2H+═Mg2++2H2O,故C正确;
D、发生酸碱中和反应,生成的应该是碳酸根离子,正确的离子方程式是:OH-+HCO3-═H2O+CO32-,故D错误;
故选C.
点评:本题考查了离子方程式的书写判断,注意电子守恒、电荷守恒的应用,可以快速判断离子方程式正误,本题难度不大.
本题难度:困难