时间:2021-02-18 06:53:14
1、选择题 下列离子方程式正确的是
A.钠和水的反应:
B.铁片和CuSO4溶液的反应:2Fe+3Cu2+═3Cu+2Fe3+
C.铝和氢氧化钠溶液的反应:↑
D.氯化铁溶液和氢氧化钠溶液的反应:Fe3++3OH═Fe(OH)3↓
参考答案:D
本题解析:分析:A.没有配平;
B.反应生成硫酸亚铁和Cu;
C.水参加反应;
D.反应生成氢氧化铁和氯化钠.
解答:A.钠和水的反应的离子反应为2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.铁片和CuSO4溶液的反应的离子反应为Fe+Cu2+═Cu+Fe2+,故B错误;
C.铝和氢氧化钠溶液的反应的离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,故C错误;
D.氯化铁溶液和氢氧化钠溶液的反应的离子反应为Fe3++3OH-═Fe(OH)3↓,故D正确;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意反应的实质,选项C中易忽略水,题目难度中等.
本题难度:一般
2、选择题 甲烷分子的结构式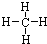
,关于其结构叙述中正确的是( )
A.甲烷分子是正方形结构
B.甲烷分子中4个碳氢键不相同
C.甲烷分子的四个键完全相同
D.甲烷分子的四个键完全不相同
参考答案:A.甲烷的结构为正四面体构型,故A错误;
B.甲烷分子中的四个键是等同的,旋转一定角度后都可以重合,故B错误;
C.甲烷的四个键完全相同,甲烷分子旋转一定角度后与旋转前完全重合,故C正确;
D.甲烷分子的四个键的键长和与碳之间的夹角均相同,故D错误;
故答案为C.
本题解析:
本题难度:简单
3、实验题 (14分)某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 的硫酸溶液进行中和热的测定。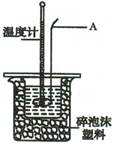 Ⅰ.配制0.50mol·L- 1 硫酸溶液
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为98%的浓硫酸 mL。
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1) ;
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c=" 4.18" J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。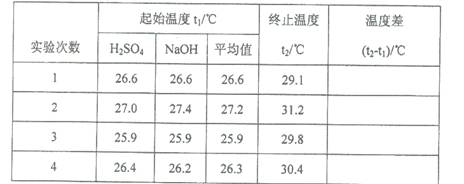
③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
参考答案:Ⅰ.(1)6.8;Ⅱ.(2)环形玻璃搅拌棒;(3)保温、隔热,减少热量的损失;(4)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l)ΔH=-57.3KJ/mol;
(5)①4.0;②-53. 5KJ/mol;③A、D。
本题解析:Ⅰ.(1)在稀释前后溶质的物质的量不变。(0.50mol/L×0.25L)×98g/mol="1.84" g·cm- 3×V×98%,解得V=6.8ml;(2)仪器A的名称为环形玻璃搅拌棒;(3)装置中碎泡沫塑料的作用是保温、隔热,减少热量的损失,是测定的温度更准确;(4)由于中和热是可溶性强酸与可溶性强碱的稀溶液发生反应产生可溶性盐和1mol的水时所放出的热量,因此该反应中和热的热化学方程式:1/2H2SO4(aq)+NaOH(aq) =1/2Na2SO4(aq)+ H2O(l)ΔH=-57.3KJ/mol;(5)由于酸、碱物质的量浓度相同,而酸是二元酸,素若取50 mL NaOH溶液和30 mL硫酸溶液进行实验,则酸过量,反应放出的热量按照碱进行计算。 ①通过对表中各组数据进行观察会发现:第一组数据偏差太大,应该舍去,因此表中的温度差平均值为[(31.2-27.2)+(29.8-25.9)+(30.4-26.4)]÷3="4.0℃;" ②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c=" 4.18" J·(g·℃)- 1 。则中和热△H=-cmt÷n=(4.18×10-3×80×4.0)KJ÷0.025mol="-53." 5KJ/mol. ③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是A.实验装置保温、隔热效果差,热量散失,使结果偏低,正确; B.量取NaOH溶液的体积时仰视读数,碱的物质的量偏大,则热量偏多,使结果偏高,错误; C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失少,误差小,错误; D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,使在测定前已经由部分发生反应,是热量测定值偏少,正确。故选项是AD。
考点:考查物质的量浓度的配制、中和热的热化学方程式的书写、中和热的计算、测定及误差分析的知识。
本题难度:一般
4、选择题 下列各组化合物中化学键类型不同的是( )
A.NaCl和HNO3
B.H2O和NH3
C.MgF2和NaCl
D.H2O和CO2
参考答案:A、NaCl为离子化合物且只含有离子键,而HNO3为共价化合物,含有共价键,化学键类型不同,故A正确;
B、H2O和NH3均为共价化合物,化学键类型相同,故B错误;
C、MgF2和NaCl均为离子化合物,化学键类型相同,故C错误;
D、CO2和H2O均为共价化合物,化学键类型相同,故D错误.
故选A.
本题解析:
本题难度:简单
5、选择题 下列说法正确的是( )
A.离子晶体中可能含有共价键,一定含有金属元素
B.分子晶体中可能不含共价键
C.非极性分子中一定存在非极性键
D.对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高
参考答案:B
本题解析:A、离子晶体中可能含有共价键,但不一定含有金属元素,A不正确;B、分子晶体中可能不含共价键,例如稀有气体元素形成的分子,B正确;C、非极性分子中不一定存在非极性键,例如CO2,C不正确;D、对于组成和结构相似的分子晶体,不一定是相对分子质量越大,熔沸点越高,例如水的熔沸点高于硫化氢的,这是由于氢键导致的,D不正确,答案选B。
本题难度:一般