时间:2021-02-18 06:47:22
1、选择题 标准状况下有①6.72LCH4 ②3.01×1023个HCl ③13.6gH2S ④0.2molNH3,下列对四种气体的关系从小到大表示不正确的是
A.体积 ④<①<③<②
B.密度 ①<④<③<②
C.质量 ④<①<③<②
D.氢原子数 ④<②<③<①
参考答案:D
本题解析:A、3.01×1023个HCl的体积V= N/ NA*Vm=0.5mol×22.4L/mol=11.2L,13.6gH2S的体积V=m/M*Vm=13.6g/34(g/mol)×22.4L/mol=8.96L,0.2molNH3的体积V=0.2mol×22.4L/mol
本题难度:困难
2、选择题 NA为阿伏加德罗常数,下列说法正确的是(?)
A.100 mL 1 mol·L-1的CH3COOH溶液中含有CH3COOH分子0.1 NA
B.等物质的量的N2和CO的质量均为28g
C.25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
D.100mL1mol/L的Na3PO4溶液中含有离子数多于0.4NA
参考答案:D
本题解析:A、由于醋酸是弱酸,故100 mL 1 mol·L-1的CH3COOH溶液中含有CH3COOH分子小于0.1 NA; B、未标明物质的量故无法判断质量;C、25℃,pH=13的NaOH溶液中含有OH-的浓度为0.1mol/L; D、100mL1mol/L的Na3PO4溶液中含有离子数多于0.4NA正确 。
本题难度:一般
3、选择题 由CO2、H2、CO组成的混合气在同温同压下与氮气的密度相同,则该混合气中CO2、H2、CO的体积比是( ?)
A.29:8:1
B.21:1:14
C.13:8:29
D.26:6:17
参考答案:C
本题解析:根据阿伏加德罗定律及其推论可知,密度之比是相应的摩尔质量之比,即混合气的平均相对分子质量是28。而氮气的相对分子质量也是28,只要满足CO2和氢气的平均摩尔质量是28g/mol即可。要满足平均相对分子质量是28,则CO2和氢气的体积之比是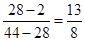 ,所以正确的答案选C。
,所以正确的答案选C。
本题难度:一般
4、选择题 向含有1mol KAl(SO4)2的溶液中加入适量的Ba(OH)2溶液,使SO42-恰好转化为沉淀,此时生成的Al(OH)3物质的量是?
A.1mol
B.1.33mol
C.0.67mol
D.0 mol
参考答案:D
本题解析:1molKAl(SO4)2能电离出2molSO42-,欲使SO42-完全沉淀,需要2molBa(OH)2,所以此时Al3+和OH-物质的量比为1:4,恰好生成AlO2-,无氢氧化铝沉淀生成。
点评:Al3+与OH-反应有两个极端情况:Al3++3OH-=Al(OH)3↓、Al3++4OH-=AlO2-+2H2O,当Al3+与OH-物质的量比为1:3时,恰好生成氢氧化铝沉淀,当Al3+与OH-物质的量比为1:4时,恰好生成AlO2-。
本题难度:一般
5、实验题 某次实验需用0.4 mol/L NaOH溶液480 mL。配制方法如下:
(1)配制该溶液应选用_______________mL容量瓶;?
(2)用托盘天平准确称量__________g 固体NaOH;
(3)将称量好的NaOH固体放在500 mL大烧杯中,倒入约300 mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待__________________后,将烧杯中的溶液注入容量瓶中;用少量蒸馏水洗涤烧杯?次,洗涤后的溶液一并转入容量瓶,轻轻晃动容量瓶,使溶液混合均匀;向容量瓶中加入蒸馏水,到液面_____________________时,改用__________加蒸馏水至液面最低点与刻度线相切。盖好瓶塞,上下颠倒混合均匀;若在配制过程中出现下列情况,将使所配制的NaOH溶液的浓度偏高的是___________,偏低的是___________,对实验结果没有影响的是___________(填各选项的序号)。
A.所用的NaOH中混有少量Na2O
B.用托盘天平称量一定质量固体NaOH时,所用的小烧杯内壁不太干燥
C.配制溶液所用的容量瓶洗净后没有烘干
D.固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶内并接着进行后续操作
E.转移溶液后,未洗涤烧杯和玻璃棒就直接定容
F.最后确定NaOH溶液体积(定容)时,俯视观察液面与容量瓶刻度线
G.定容摇匀后静止,发现液面低于刻度线,再加蒸馏水至刻度线。
参考答案:(1)500
(2)8.0?
(3)待冷却至室温后后
(4)2-3 次
(5)离刻度线1~2cm时?胶头滴管?
(6)偏高的是ADF?偏低的是EG?没有影响的是BC
本题解析:(1)因溶液的体积480mL,但容量瓶的规格没有480mL,所以选用500mL容量瓶,故答案为:500mL;
(2)需氢氧化钠的质量为m=0.5L×0.4mol?L-1×40g/mol=8.0g,故答案为:8.0;
(3)氢氧化钠溶解放出大量的热,溶液具有热胀冷缩的性质,影响溶液体积,故应先冷却至室温,故答案为:待溶液冷却至室温;
(4)为保证溶质尽可能转移到容量瓶中,需用少量蒸馏水洗涤烧杯2-3?次,并将洗涤液一起转入容量瓶中,故答案为:蒸馏水;一起转入容量瓶中;
(5)向容量瓶中加入蒸馏水,到液面离刻度线1-2cm时,改用胶头滴管加蒸馏水至液面最低点与刻度线相切.盖好瓶塞,上下颠倒混合均匀,故答案为:1~2cm;胶头滴管;上下颠倒混合均匀;
(6) A设NaOH和Na2O的质量相同为m,则NaOH的物质的量为m/40,Na+的物质的量为m/40。 Na2O的物质的量为m/52 ,Na+的物质的量为m/31。所以NaOH中混有少量Na2O会导致溶液浓度增大;B、C最后需要定容,容量瓶洗净后没有烘干,对溶液浓度无影响;D氢氧化钠溶解放出大量的热,溶液具有热胀冷缩的性质,故应先冷却至室温再移液定容,所以固体NaOH在烧杯中溶解后,立即将溶液转移到容量瓶后,进行后面的操作会使得溶液的体积变小,所以溶液浓度偏高;E转移溶液后,未洗涤烧杯和玻璃棒就直接定容,少量氢氧化钠沾在烧杯壁与玻璃棒上,氢氧化钠的实际质量减小,溶液浓度偏低;F定容时,俯视容量瓶刻度线,使溶液的体积偏低,所以溶液浓度偏高。 G.定容摇匀后静止,液面会低于刻度线,因为会有一部分溶液挂在容器壁上,如向此溶液中加蒸馏水,会将溶液稀释。
本题难度:一般