时间:2021-02-18 06:36:49
1、选择题 分析如图所示的能量变化,下列热化学方程式正确的是
A.S(s,单斜)+O2(g)=SO2(g) △H=+297.16kJ/mol
B.S(s,单斜)+O2(g)=SO2(g) △H=-296.83kJ/mol
C.S(s,正交)+O2(g)=SO2(g)△H=-296.83kJ/mol
D.单斜硫的稳定性大于正交硫的稳定性
参考答案:C
本题解析:A、根据能量变化示意图可知S(s,单斜)+O2(g)=SO2(g) △H=-297.16kJ/mol,A错误;B、根据能量变化示意图可知S(s,单斜)+O2(g)=SO2(g) △H=-297.16kJ/mol,B错误;C、根据能量变化示意图可知 S(s,正交)+O2(g)=SO2(g) △H=-296.83kJ/mol,C正确;D、单斜硫的能量高于正交硫的能量,因此单斜硫稳定性小于正交硫的稳定性,D错误,答案选C。
考点:考查反应热的有关判断
本题难度:一般
2、填空题 4gCH4在氧气中燃烧生成CO2和液态水,放出222.5kJ热量.写出CH4燃烧的热化学方程式:______.
参考答案:4gCH4在氧气中燃烧生成CO2和液态水,放出222.5kJ热量,16g即1molCH4在氧气中燃烧生成CO2和液态水,放出889kJ热量,
则热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890KJ/mol.
本题解析:
本题难度:一般
3、填空题 到目前为止,由化学能转变为热能或电能仍然是人类使用最主要的能源。
(1)化学反应中放出的热能(焓变,ΔH)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH=-185kJ/mol
E(H-H)=436 kJ/mol,E(Cl-Cl)=247 kJ/mol
则E(H-Cl)= ;
(2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol
请写出CO还原FeO的热化学方程式: ;
最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入汽油蒸汽。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆) 固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的正极反应式为 ____ ;
②放电时固体电解质里的O2-离子的移动方向是向 极移动(填正或负)。
参考答案:(1) 434 kJ/mol (2分)
(2)FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=-11 kJ/mol(2分)
(3)①O2+4e-=2O2- (2分) ②负 (1分)
本题解析:(1) 化学反应中放出的热能(焓变,ΔH)等于反应物的总键能之和与生成物的键能(E)之各的差值,计算出则E(H-Cl)=434 kJ/mol;(2) 假设三个方程式分别为:①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-25kJ/mol;②3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47kJ/mol; ③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19kJ/mol;根据盖斯定律,FeO(s)+CO(g)=Fe(s)+CO2(g) ΔH=? kJ/mol,可以求出ΔH=【①*3-②-③*2】/3=-11 kJ/mol;(3)①①电池的正极要发生得电子反应,故反应式为O2+4e-=2O2- ②在原电池中阴离子向负极移动;
考点:本题考查盖斯定律的应用和原电池电极反应式的书写。
本题难度:困难
4、选择题 已知:C(s)+O2(g)=CO2(g) △H1
CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g) △H3
4Fe(s)+3O2(g)=2Fe2O3(s) △H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
参考答案:C
本题解析:A、碳和CO燃烧均是放热反应,△H1<0,A不正确;B、二氧化碳与碳反应是吸热反应,铁在氧气中燃烧是放热反应,△H4<0,B不正确;C、②CO2(g)+C(s)=2CO(g) △H2,③2CO(g)+O2(g)=2CO2(g) △H3,则根据盖斯定律可知②+③即得到C(s)+O2(g)=CO2(g) ,△H1=△H2+△H3,C正确;D、已知④4Fe(s)+3O3(g)=2Fe2O3(s) △H4,⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s) △H5,则根据盖斯定律可知(④+⑤×2)÷3得到2CO(g)+O2(g)=2CO2(g),则△H3=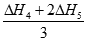 ,D错误,答案选C.
,D错误,答案选C.
考点:盖斯定律
本题难度:一般
5、选择题 在相同温度时,下列两个反应放出的热量分别为Q1和Q2:
2H2(气)+O2(气)= 2H2O(气)+Q1
2H2(气)+O2(气)= 2H2O(液)+O2
则下列判断正确的是 ( )
A.Q1>Q2
B.Q1=Q2
C.Q1<Q2
D.Q2=2Q1
参考答案:C
本题解析:
【错解分析】误选A为答案,是由于把Q2与Q1的大小搞颠倒了,造成了失误。
【正解】由于物质呈现哪一种聚集状态是跟它们含有的能量有关的,所以为了精确起见,要注明反应物和生成物的状态,才能确定放出或吸收的热量的多少。根据物质由气态变成其液态会放出热量,可推知在压强为1.01×105Pa、温度为25℃条件下所测得的数据是Q2>Q1,应选C为答案。
本题难度:一般