时间:2021-02-18 06:12:54
1、简答题 下列化合物:①HCl?②NaOH?③CH3COOH?④NH3?H2O?⑤CH3COONa?⑥NH4Cl
(1)属于弱电解质的是______,溶液呈碱性的有______(填序号).
(2)常温下0.01mol/L?HCl溶液的PH=______;pH=11的CH3COONa溶液中由水电离产生的c(OH-)=______.
(3)用离子方程式表示CH3COONa溶液呈碱性的原因______,其溶液中离子浓度按由大到小的顺序为______.
(4)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的PH仍相等,则m______n?(填“大于、等于、小于”).
(5)常温下,向100mL?0.01mol?L-1HA溶液逐滴加入0.02mol?L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①由图中信息可知HA为______酸(填“强”或“弱”).
②K点对应的溶液中,c(M+)+c(MOH)=______mol?L-1.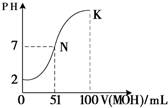
参考答案:(1)在水溶液里和熔融状态下只有部分电离的电解质是弱电解质,属于弱电解质的是一水合氨和醋酸,碱或强碱弱酸盐其溶液都呈碱性,氢氧化钠和氨水、醋酸钠溶液都呈碱性,故选:③④、②④⑤;
(2)pH=-lgc(H+)=-lg0.01=2,醋酸钠促进水电离,醋酸钠溶液中氢离子浓度为10-11mol/L,根据水的离子积常数知,氢氧根离子浓度等于10-3?mol/L,
故答案为:2、10-3?mol/L;
(3)醋酸钠是强碱弱酸盐,醋酸根离子水解生成醋酸,导致溶液中氢氧根离子浓度大于氢离子浓度而使其溶液呈碱性,水解离子方程式为:CH3COO?+H2O?CH3COOH+OH?,溶液呈碱性,所以c(OH-)>c(H+),溶液中存在电荷守恒,c(Na+)+c(H+)=c(CH3COO?)+c(OH-),则c(Na+)>c(CH3COO?),所以离子浓度大小顺序是c(Na+)>c(CH3COO?)>c(OH-)>c(H+),
故答案为:CH3COO?+H2O?CH3COOH+OH?,c(Na+)>c(CH3COO?)>c(OH-)>c(H+);
(4)醋酸是弱电解质,氯化氢是强电解质,醋酸存在电离平衡,氯化氢不存在电离平衡,将等pH的醋酸和盐酸稀释后溶液的pH仍然相等,则盐酸稀释的倍数小于醋酸,故答案为:小于;
(5)①根据图象知,0.01mol?L-1HA溶液中PH=2,氢离子浓度等于酸浓度,所以该酸是强酸,故答案为:强;
?②K点时,加入的MOH的物质的量=0.02mol?L-1×0.1L=0.002mol,混合溶液的体积是0.2L,根据物料守恒知,c(M+)+c(MOH)=0.002mol0.2L=0.01mol/L,故答案为:0.01.
本题解析:
本题难度:一般
2、选择题 100 mL pH=2的两种一元酸x和y,稀释过程中pH与溶液体积的关系如图所示。下列说法正确的(?)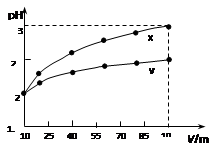
A.x为弱酸,y为强酸
B.稀释前x、y的物质的量浓度相等
C.随着稀释的进行,y的电离程度减小
D.等体积的x、y分别分别与足量的锌反应,y放出的氢气多
参考答案:D
本题解析:从图上分析,X,Y两种一元酸体积都扩大了10倍,如果两者都是强酸,那么PH值根据稀释原理和PH值计算会从2升高到3,但实际的结果是X升高到3,Y并没有升高那么多,这说明X是强酸,Y是弱酸,只有弱酸中存在电离平衡,在稀释的时候,会电离出H+来削弱PH值升高这种趋势。
由上述理由可推知:A错误,X为强酸,Y为弱酸。
B错误,Y这种弱酸只能部分电离,要使得Y的PH值与X相同,那么Y的浓度必须大于X。
C错误,稀释使电离平衡正向移动,Y的电离程度应该增大。
D正确,因为Y的浓度大于X,在等体积的情况下,Y的物质的量也是大于X的,能产生的氢气在金属足量的情况下要多于X。
本题难度:一般
3、选择题 如果盐酸的浓度是醋酸浓度的二倍,则该盐酸中H
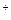 浓度与该醋酸中H
浓度与该醋酸中H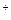 浓度的关系是 (?)
浓度的关系是 (?)
A.前者是后者的2倍
B.前者比后者的2倍大
C.前者比后者的2倍小
D.无法判断
参考答案:B
本题解析:略
本题难度:一般
4、选择题 下列事实能够说明亚硝酸(HNO2)为弱电解质的是
[? ]
A.25℃时,HNO2的水溶液的PH<7
B.亚硝酸不与硫酸钠溶液反应
C.0.1mol/L的亚硝酸水溶液的pH=2.1
D.用亚硝酸做导电实验时,灯泡很暗
参考答案:C
本题解析:
本题难度:简单
5、填空题 (3分)在滴有酚酞的氨水中加入NH4Cl溶液后红色变浅,解释:______。
参考答案: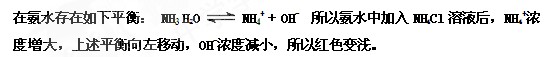
本题解析:略
本题难度:简单