时间:2021-02-18 05:55:37
1、简答题 要使饱和H2S溶液pH增大的同时,[S2─]减小,可向溶液中加入适量?①NaOH溶液;②水;③SO2;④CuSO4固体;⑤盐酸( )
A.①③⑤
B.②④⑤
C.②③
D.③④⑤
2、填空题 常温下,0.1mol/L某一元酸(HA)溶液中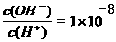 ,据此完成下列问题:
,据此完成下列问题:
(1)HA是_________ (填:强、弱)电解质;其电离方程是:_____________________________ ;
(2)常温下,0.1mol/L某一元酸(HA)溶液pH=__________________________ ;
(3)加水稀释时,溶液中 的值____________ (填:增大、不变、减小)
的值____________ (填:增大、不变、减小)
3、选择题 下列关于电解质溶液的叙述正确的是
A.常温下物质的量浓度相等①NH4HSO4、②(NH4)2SO4、③(NH4)2CO3三种溶液中c(NH4+) ①<②<③
B.在纯水中加入少量硫酸或硫酸铵,均可抑制水的电离
C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同
D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大
4、选择题 已知弱酸的电离平衡常数如下表: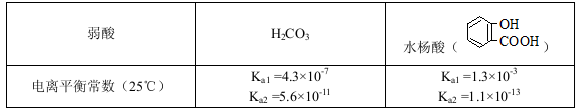
下列选项正确的是
A.常温下,等浓度、等体积的NaHCO3溶液pH小于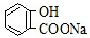 溶液pH
溶液pH
B.常温下,等浓度、等体积的Na2 CO3溶液和 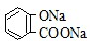 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者
C.
D.水杨酸的第二级电离 Ka2远小于第一级电离Ka1的原因之一是 能形成分子内氢键
5、填空题 如图所示,一定温度下,冰醋酸加水稀释过程中溶液的导电能力曲线图,请回答。 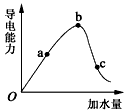
(1)O点为什么不导电 __________________。
(2)a、b、c三点的氢离子浓度由小到大的顺序为__________。
(3)a、b、c三点中,醋酸的电离程度最大的一点是__________。
(4)若使c点溶液中的c(CH3COO-)提高,在如下措施中,可选择__________。
A.加热 B.加很稀的NaOH溶液 C.加固体KOH D.加水 E加固体CH3COONa
F.加Zn粒 G.加MgO固体 H.加Na2CO3固体
(5)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是__________________。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.c(H+)/c(CH3COOH)