时间:2021-02-18 05:54:16
1、填空题 (1)下列盐溶液中能发生水解的用离子方程式表示,不能发生水解的请写上“不发生水解”字样,并说明溶液的酸碱性:
K2CO3______,溶液呈______性;
K2SO4______,溶液呈______性;
NH4Cl______,溶液呈______性.
(2)物质的量浓度均为0.1mol/L的下列溶液:①KNO3、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH、⑦Ba(OH)2、⑧NH4Cl,pH由大到小的顺序为:______(填数字代号)
(3)现有常温下的0.1mol?L-1Na2CO3溶液:
①你认为该溶液呈碱性的原因是(用离子方程式表示)______;
②为证明你的上述观点,请设计一个简单的实验,简述实验过程______.
2、填空题 (6分)写出下列盐水解的离子方程式:
① CH3COONa
② (NH4)2SO4
③ NaHCO3
3、填空题 (16分)I.合成氨的原料气H2可通过反应CO(g)+H2O(g)  CO2 (g) +H2(g) 获取。
CO2 (g) +H2(g) 获取。
(1)T ℃时,向容积固定为5 L的容器中充入1 mol水蒸气和1 mol CO,反应达平衡后,测得CO的浓度为0.08 mol·L-1,则平衡时CO的转化率为 ,该温度下反应的平衡常数K值为 。
(2)保持温度仍为T ℃,改变水蒸气和CO的初始物质的量之比,充入固定容器中进行反应,下列描述能够说明体系处于平衡状态的是 (填序号)。
a.容器内压强不随时间改变
b.混合气体的密度不随时间改变
c.单位时间内生成a mol CO2的同时消耗a mol H2
d.混合气中n (CO) : n (H2O) : n (CO2) : n (H2) = 1 : 16 : 6 : 6
II.(1)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视。它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势。氨在燃烧实验中相关的反应有:
①4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H1
②4NH3(g)+5O2(g)=4NO(g)+6H2O(l) △H2
③4NH3(g)+6NO(g)=5N2(g)+6H2O(l) △H3
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= 。
(2)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置用铂作为电极、加入碱性电解质溶液,其电池反应为4NH3+3O2=2N2+6H2O
①写出该燃料电池的正极反应式 。
②若用该燃料电池产生的电能在铁皮上镀锌(制白铁皮),某铁皮上现需要镀上9.75g锌,理论上至少需要消耗标准状况的氨气 L。
III.(1)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。由图可知Mg与卤素单质的反应均为 (填“放热”或“吸热”)反应。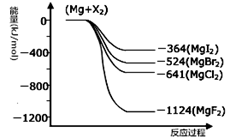
(2)金属Mg与CH3Cl在一定条件下反应可生成CH3MgCl,CH3MgCl是一种重要的有机合成试剂,易与水发生水解反应并有无色无味气体和沉淀生成。写出CH3MgCl水解的化学方程式 。
4、填空题 回答下列问题:
(1)有一种溶液除H+、OH-外,还有Na+、SO42-和Cl-,测得三种离子的浓度分别是0.01 mol·L-1、0.0035 mol·L-1和 0.004 mol·L-1,该溶液的pH为______________ 。
(2) NH4Cl溶液显酸性,试用离子方程式表示这一反应_________________ 。
(3)液氨类似于水的电离,试写出液氨的电离方程式___________________;在液氨中加入NH4Cl,则平衡将向__________移动。
(4)pH相同的氨水和氢氧化钠溶液,分别用蒸馏水稀释至原来体积的m倍和n倍,稀释后两溶液的pH仍相同,则m____n(选填“>”“<”或“=”);若改用pH相同的盐酸和硫酸溶液,进行上述操作,则m________n(选填“>” “<”或“=”)。
5、选择题 为了使K2S溶液中c(K+)/c(S2-)的比值变小,可加入的物质是
①适量HCl(g);②适量NaOH(s);③适量KOH(s);④适量NaHS(s);⑤适量的水
A.②④
B.①②⑤
C.③④⑤
D.②③