ʱ��:2021-02-18 05:53:10
1��ѡ���� ����˵�����ʾ������ȷ���ǣ�������
A����ϩ�Ľṹ��ʽCH2CH2
B����ѧ���ʣ������������������������
C���Ӻ�ˮ����ȡ��ʱ�����漰������ԭ��Ӧ
D������ϩ�Ľṹ��ʽΪ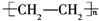
�ο��𰸣�A����ϩ�����к���̼̼˫�����ṹ��ʽΪ��CH2�TCH2����A����
B����֬�������࣬�������������������ʣ���B����
C����ˮ��ȡ���ԭ���������������������Ĺ��̣���������ԭ��Ӧ����C����
D������ϩ����ϩ�Ӿ۵IJ���ṹ��ʽΪ��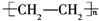
����D��ȷ��
��ѡD��
���������
�����Ѷȣ�һ��
2��ѡ���� ��֪MO4x-��2SO32-��4H+��M2+��2SO42-��2H2O����MO4x-�е�M�Ļ��ϼ�Ϊ
[? ]
A����2
B����3
C����4
D����6
�ο��𰸣�D
����������������ݵ���غ��֪-x-2��2+4��1=+2-2��2���Ӷ���֪x=2���پ����������У����ϼ۵Ĵ����͵�����������������M-2��4=-2�Ӷ���֪M=+6�����Դ�ѡD
�����Ѷȣ���
3������� ϡHNO3��п��Ӧ�Ļ�ѧ����ʽ���£�4Zn+10HNO3=4Zn��NO3��2+N2O��+5H2O
��1����˫���ű���������ѧ����ʽ�е���ת�Ƶķ������Ŀ______��
��2���÷�Ӧ�л�ԭ����______����ԭ������______��ÿ2mol?Zn�μӷ�Ӧ��ת�Ƶĵ���______����
��3��������Ӧ�У�HNO3û��ȫ���μ�������ԭ��Ӧ��û�вμ�������ԭ��Ӧ������������������ʵ���֮����______��
�ο��𰸣���1���ڷ�Ӧ4Zn+10HNO3=4Zn��NO3��2+N2O��+5H2O�У�ZnԪ�ػ��ϼ����ߣ���0������Ϊ+2�ۣ�ʧȥ���ӣ�NԪ�ػ��ϼ۽��ͣ���+5�۽���Ϊ+1�ۣ��õ����ӣ�����ת�Ƶķ������Ŀ�ɱ�ʾΪ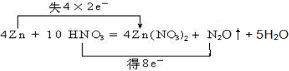
��
�ʴ�Ϊ��
��
��2���ɻ��ϼ۱仯��֪��ԭ��ΪZn��N2OΪ��ԭ���ÿ2mol?Zn�μӷ�Ӧ��ת�Ƶĵ���Ϊ4NA��
�ʴ�Ϊ��Zn��N2O��4NA��
��3���ɻ��ϼ۱仯��֪10mol����μӷ�Ӧ��ֻ��2mol����ԭ����û�вμ�������ԭ��Ӧ������������������ʵ���֮����4��5���ʴ�Ϊ��4��5��
���������
�����Ѷȣ���
4��ѡ���� �й�������ԭ��Ӧ��������ȷ���ǣ�������
A����������������������Ӧ
B��������ԭ��Ӧ��ʵ����Ԫ�ػ��ϼ۵�����
C��������ֻ�������ԣ�������ֻ�л�ԭ��
D����������Ԫ�ػ��ϼ����ߵķ�Ӧ��������Ӧ
�ο��𰸣�A���������õ��ӱ���ԭ��������ԭ��Ӧ����A����
B��������ԭ��Ӧ��ʵ��Ϊ���ӵ�ת�ƣ���B����
C����Fe2+���Ⱦ���������Ҳ���л�ԭ�ԣ�ClO-����ǿ�����ԣ���C����
D����������Ԫ�ػ��ϼ����ߣ�ʧ���ӱ���������D��ȷ��
��ѡD��
���������
�����Ѷȣ�һ��
5��ѡ���� ���л�ѧ��Ӧ�У�����������ԭ��Ӧ���ǣ�������
A��NaOH+HCl=NaCl+H2O
B��H2CO3=H2O+CO2
C��NH3+HCl=NH4Cl
D��2FeCl2+Cl2=2FeCl3
�ο��𰸣�A��Ϊ����кͷ�Ӧ��û�з���������ԭ��Ӧ����A��ѡ��
B��Ϊ̼��ķֽⷴӦ��û�з���������ԭ��Ӧ����B��ѡ��
C����Ԫ�صĻ��ϼ۶�û�з����仯������������ԭ��Ӧ����C��ѡ��
D��Fe��Cl�Ļ��ϼ۷����仯������������ԭ��Ӧ����Dѡ��
��ѡD��
���������
�����Ѷȣ���