时间:2021-02-18 05:49:32
1、选择题 为把溴水中溴单质萃取出来,应加入( )
A.苯
B.苯酚溶液
C.乙醇
D.乙醛
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列各项操作错误的是( )
A.用酒精萃取溴水中的溴单质的操作可选用分液漏斗,而后静置分液
B.进行分液时,分液漏斗中的下层液体从下端流出,上层液体则从上口倒出
C.萃取、分液前需对分液漏斗检漏
D.为保证分液漏斗内的液体顺利流出,需将上面的塞子拿下(或使塞上的凹槽对准漏斗上的小孔)
参考答案:A
本题解析:
本题难度:简单
3、选择题 设NA表示阿伏加德罗常数的值。下列说法正确的是 ? ? ? ? ? ? ? ? ? ? ?(附相对原子质量:H--1?C--12?Si--28?O-16)
A.1.5 g CH3+ 含有的电子数为NA
B.在1 L 0.1 mol/L氯化铝溶液中阳离子总数大于0.1 NA
C.60g SiO2和12g金刚石中各含有4NA个Si-O键和4NA个C-C键
D.标准状况下,11.2 L四氯化碳中含有的C—Cl 键的个数为2NA
参考答案:B
本题解析:1.5 g CH3+ 含有的电子数为0.8NA,A错;在1 L 0.1 mol/L氯化铝溶液中阳离子除了Al3+还有H+,故阳离子总数大于0.1 NA,B正确; 60g SiO2和12g金刚石中各含有4NA个Si-O键和2NA个C-C键;标准状况下,四氯化碳是液态,故D错。
本题难度:困难
4、选择题 下列物质可以通过溶解、过滤、蒸发的方法分离的是( )
A.氯化银和碳酸钙
B.酒精和水
C.硫酸镁和氯化钠
D.硫酸钡和氯化镁
参考答案:由于利用溶解、过滤、蒸发的方法分离物质中,两者必选都是固体物质,有且只有一种不能够溶解,所以要判断给定物质中哪一种不能溶解就可以.
A、氯化银和碳酸钙都不溶于水,无法采用上述方法分离,故A错误;
B、酒精和水是互溶的液体,不可以用上述方法分离,故C错误;
C、泥土和粉笔灰.两种物质都不能溶解于水,所以不可以用该法进行分离.故C错误;
D、硫酸钡是难溶于水的固体,氯化镁是易溶于水的,可以采用上述方法分离,故D正确.
故选D.
本题解析:
本题难度:简单
5、实验题 (12分)信息时代产生的大量电子垃圾对环境构成了极大的威胁。某“变废为宝”学生探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: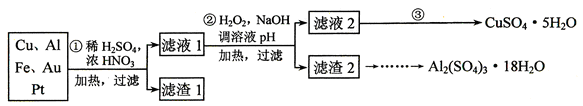
请回答下列问题:
⑴ 第①步Cu与混酸反应的离子方程式为______________________________;
得到滤渣1的主要成分为______________? _____。
⑵ 第②步加H2O2的作用是_____________________,使用H2O2的优点是_________;调溶液pH的目的是使_______________________________生成沉淀。
⑶ 简述第③步由滤液2得到CuSO4·5H2O的方法是________________________ 。
⑷ 由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: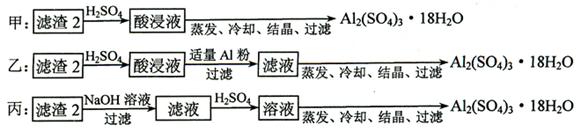
上述三种方案中,_________________方案不可行,原因是_________________________:
从原子利用率角度考虑,___________方案更合理。
⑸ 探究小组用滴定法测定CuSO4·5H2O (Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2+ + H2Y2-= CuY2- + 2H+
写出计算CuSO4·5H2O质量分数的表达式ω= _____________________________ ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是_____________。
a.未干燥锥形瓶? b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
参考答案:⑴ Cu + 4H+ + 2NO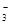
 Cu2+ + 2NO2↑+ 2H2O?或
Cu2+ + 2NO2↑+ 2H2O?或
3Cu + 8H+ + 2NO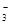
 3Cu2+ + 2NO↑+ 4H2O? Au、Pt
3Cu2+ + 2NO↑+ 4H2O? Au、Pt
⑵ 将Fe2+氧化为Fe3+?不引入杂质,对环境无污染? Fe3+、Al3+
⑶ 蒸发冷却?结晶过滤
⑷ 甲?所得产品中含有较多Fe2(SO4)3杂质?乙
⑸ 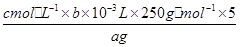 ?× 100%? c
?× 100%? c
本题解析:(1)浓硝酸具有强氧化性,能把铜氧化生成硝酸铜、NO和水,反应的方程式是 Cu + 4H+ + 2NO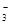
 Cu2+ + 2NO2↑+ 2H2O。由于浓硝酸和硫酸都不能溶解Au或Pt,所以滤渣是1的主要成分为Au、Pt。
Cu2+ + 2NO2↑+ 2H2O。由于浓硝酸和硫酸都不能溶解Au或Pt,所以滤渣是1的主要成分为Au、Pt。
(2)由于滤液中可能含有亚铁离子,所以加入双氧水的目的是将Fe2+氧化为Fe3+,然后生成氢氧化铁沉淀而除去。双氧水的还原产物是水,所以双氧水作为氧化剂的优点是不引入杂质,对环境无污染。要回收铜,就必需除去溶液中的铁离子和铝离子,所以调溶液pH的目的是使Fe3+、Al3+形成沉淀而除去。
(3)硫酸铜易溶于水,所以要得到硫酸铜晶体需要经过蒸发、冷却、结晶、过滤。
(4)由于甲方案中硫酸和氢氧化铁及氢氧化铝都是反应的,所以生成的滤液中含有硫酸铁和硫酸铝。因此如果直接蒸发,将使所得产品中含有较多Fe2(SO4)3杂质。由于铝的金属性强于铁的,所以方案乙中铝能置换出铁,从原子利用率最高。而方案丙中生成的硫酸铝小于方案乙中生成的硫酸铝,原子利用率没有乙高。
(5)消耗EDTA的物质的量是0.001bcmol,所以根据反应的方程式可知,消耗铜离子的物质的量也是0.001bcmol,所以每一份中胆矾的物质的量是0.001bcmol。因此CuSO4·5H2O质量分数的表达式ω=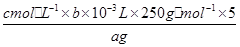 ?× 100% 。根据表达式可知,如果未干燥锥形瓶,是不会影响实验结果的。若滴定终点时滴定管尖嘴中产生气泡,则消耗标准液的体积将减少,测定结果偏低;如果未除净可与EDTA反应的干扰离子,则消耗标准液的体积将偏大,测定结果偏高,因此答案选C。
?× 100% 。根据表达式可知,如果未干燥锥形瓶,是不会影响实验结果的。若滴定终点时滴定管尖嘴中产生气泡,则消耗标准液的体积将减少,测定结果偏低;如果未除净可与EDTA反应的干扰离子,则消耗标准液的体积将偏大,测定结果偏高,因此答案选C。
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,要求考生必须冷静的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能正确作答。
探究性实验的一般思路
1、准确地把握实验目的
2、利用已学知识,分析如何实现这个目的--实验原理
3、结合实验材料,初步确定设计对策--实验方案
本题难度:一般