时间:2021-02-18 05:34:58
1、实验题 (9分)酸碱中和滴定是中学化学常见实验。
某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B.量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D.将物质的量浓度为1.50mol/L标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E.继续滴定至终点,记下读数为V2。
F.在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G.量取浓硫酸样品5mL,在烧杯中用蒸馏水溶解。
H.重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为:
→ A→ →  →D→ → → H
→D→ → → H
(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是 ;量取20.00mL稀硫酸的仪器是 。
(3)选用的指示剂是 。滴定过程中,视线应注视 ;判断到达滴定终点的现象是 。
(4)下表是实验测得的有关数据:
| 滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
| V1 | V2 | ||
| ① | 20.00 | 0.50 | 22.60 |
| ② | 20.00 | 6.00 | 27.90 |
2、选择题 已知下列热化学方程式:(l) C(s)+1/2O2(g)=CO(g)?△H =△H1
(2)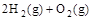 ?=2H2O(g)?△H=△H2
?=2H2O(g)?△H=△H2
由此可知 C(s)+ H2O(g) ==?CO(g) + H2(g)?ΔH3。则?ΔH3等于? (? )
A.△H1-△H2
B.△H1-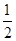 △H2
△H2
C.2△H1-△H2
D.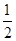 △H2 -△H1
△H2 -△H1
3、选择题 313 K时,水的KW=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液(?)
A.呈酸性
B.呈中性
C.呈碱性
D.无法判断
4、选择题 等浓度的下列物质的水溶液,加热到80℃,忽略水的蒸发,溶液的pH不变的是(?)?
A.Na2CO3
B.NaOH
C.Na2SO4
D.H2SO4
5、填空题 (10分)现在城市居民使用的管道煤气的主要成分是H2、CO和少量CH4。H2、CO和CH4的燃烧热数据如下表
| 物质 | H2 | CO | CH4 |
| 燃烧热kJ?mol-1 | 285.8 | 283.0 | 890.3 |