时间:2021-02-18 05:28:06
1、填空题 (10分)研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。在催化剂作用下,CO可用于合成甲醇:CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
(1)若在恒温恒压的条件下,向密闭容器中充入4 mol CO和8 mol H2,合成甲醇,平衡时CO的转化率与温度、压强的关系如图所示: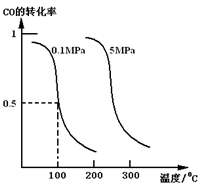
①该反应的正反应属于________反应(填“吸热”或“放热”)。
②在0.1 MPa、100 ℃的条件下,该反应达到平衡时容器内气体的物质的量为_________mol。
(2)若在恒温恒容的条件下,向上述平衡体系中充入4 mol CO,8 mol H2,与(1)相比,达到平衡时CO转化率_______(填“增大”,“不变”或“减小”), 平衡常数K_______(填“增大”,“不变”或“减小”)。
(3)在上述合成甲醇的反应中需要用到H2做反应物,以甲烷为原料制取氢气是工业上常用的制氢方法。已知:①CH4(g) + H2O(g) = CO(g) + 3H2(g) ΔH =" +206.2" kJ·mol-1
②CH4(g) + CO2(g) =" 2CO(g)" + 2H2(g) ΔH =" +247.4" kJ·mol-1
则CH4和H2O(g)反应生成CO2和H2的热化学方程式为: 。
参考答案:(1) ①放热 (2分) ②8 (2分) (2)减小(2分) 不变 (2分)(3) CH4(g) + 2H2O(g) ="==" CO2(g) + 4H2(g) ΔH =" +165.0" kJ·mol-1 (2分)
本题解析:(1) ①从图看出,压强不变时,温度越高转化率越低,说明升高温度平衡向逆向移动,故反应为放热反应。②在0.1 MPa、100 ℃的条件下CO的转化率为0.5,根据反应方程式:
CO(g) + 2H2(g)  CH3OH(g)。
CH3OH(g)。
n(起始)/ mol 4 8 0
n(变化)/ mol 2 4 2
n(平衡)/mol 2 4 2 所以平衡时气体总物质的量为8mol.
(2)反应是一个气体压强减小的反应,如果在恒温恒容的条件下反应,相对于(1)是减小了压强,平衡向逆向移动,CO的转化率减小。平衡常数只与温度有关,温度没有变,平衡常数不发生改变。 (3)将①×-②可得CH4和H2O(g)的反应方程式,则ΔH =206.2×2-247.4="+165.0" kJ·mol-1,故CH4和H2O(g)反应生成CO2和H2的热化学方程式为:CH4(g) + 2H2O(g) ="==" CO2(g) + 4H2(g) ΔH =" +165.0" kJ·mol-1
考点:化学平衡图像、化学平衡的移动和热化学方程式的计算。
本题难度:困难
2、选择题 N2(g)+3H2(g) 2NH3(g)(正反应放热),在某一时间段中反应速率与反应过程的曲线关系如图。下列说法正确的是
2NH3(g)(正反应放热),在某一时间段中反应速率与反应过程的曲线关系如图。下列说法正确的是 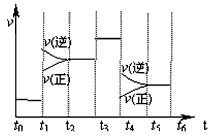
[? ]
A.氨气的体积分数最高的一段时间为t5-t6
B.t2-t3和t3-t4时间段氨气的体积分数相等
C.t1时刻改变的条件是降低温度
D.t4-t5时间段平衡向正反应方向移动
参考答案:B
本题解析:
本题难度:一般
3、填空题 (10分)1000℃时,硫酸钠可与氢气发生反应: Na2SO4(s)+4H2(g)  Na2S(s)+4H2O(g)。请回答下列问题:
Na2S(s)+4H2O(g)。请回答下列问题: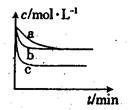
(1)上述反应的平衡常数表达式为: 。
(2)上述反应在三个不同条件下进行,与曲线a比较,b和c分别仅改变一种反应条件,其中H2的浓度随时间的变化如图所示。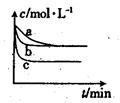
①则曲线b改变的条件为
②该反应的△H___0(填“>”、“<”或“=”)。
(3)该温度下,向2 L盛有1.42 g Na2SO4的密闭恒容容器中通入H2,5 min
后测得固体质量为1.10 g。
①则该时间范围内的平均反应速率v(H2)= 。
②能说明该反应已达到平衡状态的是 (填字母,下同)。
A.容器内压强保持不变
B.容器内气体密度保持不变
C.c(H2)=c(H2O)
D.v正(H2)=v逆(H2O)
参考答案:
(1)c 4(H2O)/ c 4(H2)
(2)①使用催化剂 ② >。
(3)①0.002 mol/(L.min) ; ②B、D 。
本题解析::(1)根据题给化学方程式结合平衡常数表达式的书写原则写出上述反应的平衡常数表达式为:c4(H2O)/c4(H2);(2)①根据题给图像分析,与曲线a比较,曲线b缩短了达平衡的时间,氢气的平衡浓度未发生变化,则曲线b改变的条件为使用催化剂;②与曲线a比较,曲线c缩短了达平衡的时间,氢气的平衡浓度减小,则曲线c改变的条件为升高温度; 温度升高,达平衡时间缩短,平衡时H2浓度减少,说明升高温度平衡向正反应方向移动。该反应的△H>0;(3)①该温度下,向2L盛有1.42g Na2SO4的密闭容器中通入H2,5min后测得固体质量为1.10g,固体质量减少0.32g,利用差量法计算,则该时间范围内参加反应氢气的物质的量0.02mol,根据v=△n/V△t计算,则该时间范围内的平均反应速率v(H2)=0.002mol/(L.min);②A、该反应为反应前后气体物质的量不变的反应,容器内压强不随反应的进行而变化,不能作为平衡标志,错误;B、容器内气体密度随反应的进行而变化,密度不变已达平衡,正确;C、达平衡后c(H2)和c(H2O)不一定相等,错误;D、v正(H2)=v逆(H2O),说明反应已达平衡,正确;答案选B、D。
考点:化学平衡常数、反应速率
本题难度:一般
4、填空题 工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g) +2H2(g) CH3OH(g) ;△H
CH3OH(g) ;△H
(1)能判断反应达到平衡状态的是____(填字母)。
A.生成CH3OH与消耗H2的速率比为1:2
B.容器内气体密度保持不变
C.容器内气体的平均相对分子质量保持不变
D.容器内各种成分的浓度保持不变
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。 
①由表中数据判断△H____(填“>”“<”或“=”)0;
②某温度下,将2 mol CO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO) =0.2
mol/L,则CO的转化率为____,此时的温度为____
(3)要提高CO的转化率,可以采取的措施是___。
a.升温 b.降温 c.压缩体积加压 d.充入惰性气体加压 e.充入CH3OH加压
f.按n(CO): n(H2)<1:3的比例充入气体加压
g.按n(CO):n(H2)>1:3的比例充入气体加压
h.分离出甲醇
(4)300℃一定压强下,5 mol CO与足量的H2在催化剂作用下恰好完全反应时放出454 kJ的热量。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
下列说法正确的是____。
A.2c1>c3 B.a+b<90. 8 C.2P2<p3 D.α1+α3<1
参考答案:(1)CD
(2)①<;②80%;250℃
(3)bfh
(4)D
本题解析:
本题难度:一般
5、填空题 煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数随温度的变化如下表:
CO2(g)+H2(g)的平衡常数随温度的变化如下表: 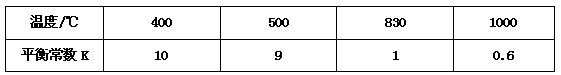
试回答下列问题
(1)上述反应的正反应是_____________ 反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率 _________(填“增大”、“减小”或“不变”),容器内混合气体的压强____________ (填“增大”、“减小”或“不变”)。
(3)830℃,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 ________(选填A、B、C、D)。 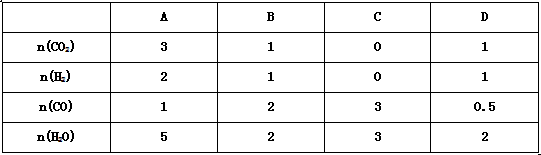
(4)830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是________ 。
参考答案:(1)放热
(2)增大;增大
(3)B、C,
(4)60%
本题解析:
本题难度:一般