时间:2021-02-18 04:56:03
1、选择题 25℃时,在20mL?0.1mol/L NaOH溶液中逐滴加入0.2mol/L醋酸溶液,曲线如图所示,
有关粒子浓度关系的比较中,不正确的是( )
A.在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B.在B点:c(OH-)═c(H+),c(Na+)═c(CH3COO-)
C.在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D.在C点:c(CH3COO-)+c(CH3COOH)═2c(Na+)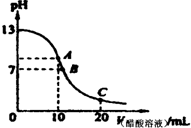
参考答案:A
本题解析:
本题难度:一般
2、选择题 常温下,将0.1mol?L-1氢氧化钠溶液与0.06mol?L-1硫酸溶液等体积混合,该混合溶液的pH等于( )
A.1.7
B.2.0
C.12.0
D.12.4
参考答案:设溶液的体积都是1L,则氢氧化钠的物质的量为1L×0.1mol?L-1=0.1mol,
硫酸的物质的量为1L×0.06mol?L-1=0.06mol,H+的物质的量为0.06mol×2=0.12mol,
则当酸碱发生中和时H+和OH-的物质的量分别为0.12mol和0.1mol,
则硫酸过量,过量的H+的物质的量为0.12mol-0.1mol=0.02mol,
则反应后溶液中H+的物质的量浓度为c(H+)=0.02mol2L=0.01mol?L-1,
pH=-lg10-2=2.0,故选:B.
本题解析:
本题难度:一般
3、选择题 某温度下,CO2饱和溶液的浓度是0.03 mol/L,其中1/3的CO2转变为H2CO3,而H2CO3仅有0.1%发生如下电离:H2CO3 H++ HCO3-,则溶液的pH约为
H++ HCO3-,则溶液的pH约为
[? ]
参考答案:C
本题解析:
本题难度:一般
4、选择题 常温下用pH为3的某酸(HA)溶液与pH为11的氨水、等体积混合得混合溶液,关于这种所得溶液酸碱性的描述正确的是( )
A.溶液一定显碱性
B.溶液一定显酸性
C.溶液不可能显中性
D.溶液可能显中性、酸性或碱性
参考答案:D
本题解析:
本题难度:简单
5、选择题 有3种溶液①0.01mol?L-1醋酸;?②0.02mol?L-1醋酸与0.02mol?L-1NaOH等体积混合后的溶液;③0.04mol?L-1醋酸与0.02mol?L-1?NaOH等体积混合后的溶液.下列说法不正确的是( )
A.3种溶液中pH最小的是①
B.②和③溶液中所含微粒种类相同
C.3种溶液中c(CH3COO-)大小顺序是③>②>①
D.向②中加少量的CH3COONa固体则
| c(CH3COO-) c(Na+) |
参考答案:D
本题解析:
本题难度:简单