时间:2021-02-18 04:44:46
1、选择题&nb sp; 已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11下列说法正确的是
A.25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,后者Ca2+浓度大
B.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,会析出CaCO3固体
C.25℃时,CaCO3固体在20mL0.01mol·L-1盐酸中的Ksp比在20mL0.01mol·L-1氨水中的Ksp大
D.25℃时,在CaCO3悬浊液中加入NaF固体,CaCO3不可能全转化为CaF2
参考答案:AB
本题解析:A.25℃时,CaCO3的Ksp为2.9×10-9,则c2(Ca2+)=2.9×10-9,CaF2的Ksp为2.7×10-11,则c3(Ca2+)=6.75×10-12,所以Ca2+浓度后者大,正确;B.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,由于c (Ca2+)较大,c (Ca2+)·c(CO32-)>Ksp(CaCO3)所以会析出CaCO3固体,正确;C.物质的溶度积常数只与温度有关,而与其它条件无关,所以25℃时,CaCO3固体在20mL0.01mol·L-1盐酸中的Ksp比在20mL0.01mol·L-1氨水中的Ksp相同,错误;D.25℃时,在CaCO3悬浊液中加入NaF固体,若c (Ca2+)·c2(F-)>Ksp(CaF2),则CaCO3可能全转化为CaF2,错误。
考点:考查溶度积常数在离子浓度大小比较、沉淀的转化等的应用的知识。
本题难度:一般
2、填空题 已知Ksp(Ag2S)=1.6×10-49,Ksp(CuS)=6.3×10-36,Ksp(PbS)=8×10-28,则推断可以实现的沉淀转化关系为________________。
参考答案:PbS→CuS→Ag2S
本题解析:
本题难度:一般
3、选择题 已知AgCl能溶于氨水而生成[Ag(NH3)2]+.NH4Cl溶液和AgNO3溶液混合后,再滴入NaOH溶液,溶液中沉淀量y与NaOH溶液加入量x的关系曲线不可能是( )
A.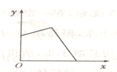
B.
C.
D.
参考答案:分析时应注意考虑到NH4Cl溶液和AgNO3溶液混合后,二者是否能恰好反应完,若不能,AgNO3是否过量,因为Ag+在碱性条件下可生成AgOH沉淀.
A、若AgNO3过量,加入NaOH后,开始时沉淀量增加,后来因有一部分AgCl沉淀转化为[Ag(NH3)2]+而减少,因NH4+的量不足,故沉淀不可能全部转化为[Ag(NH3)2]+,故A错误;
B、若AgNO3过量,加入NaOH后,开始时沉淀量增加,后来因有一部分AgCl沉淀转化为[Ag(NH3)2]+而减少,因NH4+的量不足,故沉淀不可能全部转化为[Ag(NH3)2]+,故B正确;
C、若混合前n(NH4Cl)≥2n(AgNO3),加入足量NaOH后沉淀全部溶解,故C正确;
D、若2n(AgNO3)>n(NH4Cl)>n(AgNO3),加入一定量NaOH溶液,沉淀部分溶解,故D正确;
故选A.
本题解析:
本题难度:简单
4、选择题 NaHSO4溶于水的过程中,发生了变化的化学键有?(?)
A.既有离子键、又有共价键
B.共价键
C.离子键
D.化学键未发生变化
参考答案:A
本题解析:NaHSO4在水中电离时,Na+与SO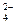 之间的离子键及H与O之间的共价键均断裂
之间的离子键及H与O之间的共价键均断裂
本题难度:简单
5、选择题 已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可作钡餐,BaCO3不能作钡餐的主要理由是( )
A.BaSO4的溶度积常数比BaCO3的小
B.S没有毒性,C有毒性
C.BaSO4的密度大
D.胃酸能与C结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
参考答案:D
本题解析:BaSO4可作钡餐是因为硫酸钡不溶于酸。而BaCO3能与酸反应:BaCO3+2H+ Ba2++H2O+CO2↑,生成的Ba2+进入人体,会造成重金属盐中毒。所以D正确。
Ba2++H2O+CO2↑,生成的Ba2+进入人体,会造成重金属盐中毒。所以D正确。
本题难度:一般