时间:2021-02-18 04:42:58
1、填空题 在下列事实中,什么因素影响了化学反应的速率?
(1)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体。 。
(2)同浓度、同体积的盐酸中放入同样大小的锌粒和镁条,产生气体有快有慢。 。
(3)同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,反应速率不同。 。
(4)工业上常将固体燃料粉碎进行燃烧。 。
(5)夏天的食品易霉变,冬天就不易发生该现象。 。
参考答案:(1)催化剂 (2)反应物的性质 (3)反应物的浓度
(4)反应物的接触面积 (5)反应温度
本题解析:可以根据影响化学反应速率的因素方面进行分析、判断,从而得出正确的结论。
(1)熔化的氯酸钾放出气泡很慢,若加入少量Mn02时分解加速.说明化学反应速率受催化剂的影响。
(2)同浓度、同体积的盐酸中放入同样大小的锌粒和镁条,产生气体有快有慢,这说明越小化学反应速率的因素是反应物自身的性质。
(3)同样大小的石灰石分别在0.1mol·L-1的盐酸和1mol·L-1的盐酸中,反应速率不同,这是由于盐酸的浓度不同引起的,反应物的浓度越大,反应速率越快。
(4)固体燃料粉碎,燃烧更快.说明反应物的接触面积越大,反应的速率大。
(5)夏天的食品易霉变,冬天就不易发生该现象,这是由于夏天气温高,故食品易霉变,而冬天气温低不易发生该现象,因此温度高低对反应速率有影响,温度越高反应速率越快。
考点:考查外界条件对化学反应速率的影响
点评:该题是基础性试题的考查,难度不大。明确反应速率的含义以及影响因素是答题的关键。因此解答本题时要充分理解影响化学反应速率的因素,然后才能对问题做出正确的判断。
本题难度:一般
2、实验题 (1)已知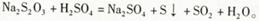 甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为l0mL):
甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下(所取溶液体积均为l0mL):
其他条件不变时:探究温度对化学反应速率的影响,应选择实验_______(填实验编号);若同时选择实验①、实验②、实验③,测定混合液变浑浊的时问,可探究_____对化学反应速率的影响。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。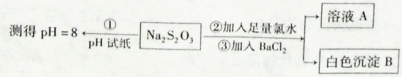
用离子方程式表示Na2S2O3溶液具有碱性的原因_______,实验操作①中测试时pH试纸的颜色应该接近 _______。
A.红色
B.深蓝色
C.黄色
D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的______性。
参考答案:(1)①⑤或②④?比较改变不同反应物浓度对反应速率的影响;(2)S2O32-+H2O HS2O3-+OH-? D?还原
HS2O3-+OH-? D?还原
本题解析:(1)若要探究温度对化学反应速率的影响,应该是只改变温度,而其他条件不变。可选择实验组合为①⑤或②④.由于 实验①、实验②、实验③的温度相同,只是反应物的浓度不同。测定混合液变浑浊的时问,可探究的是不同的反应物的浓度对化学反应速率的影响。(2)Na2S2O3是强碱弱酸盐。弱酸根离子发生水解反应,消耗水电离产生的H+,破坏了水的电离平衡,水继续电离直至达到新的平衡状态。由于整个溶液中c(OH-)>c(H+).所以溶液呈碱性。水解的两种方程式为:S2O32-+H2O HS2O3-+OH-。在溶液的pH=8时,pH试纸的颜色应该接近绿色。因此选项为D。因为Na2S2O3有还原性,氯水有氧化性,二者发生氧化还原反应:Na2S2O3+4Cl2+5H2O=2NaCl+2H2SO4+6HCl.产生SO42-。再加入BaCl2溶液时发生沉淀反应:SO42-+Ba2+="Ba" SO4↓。因此实验②、③的目的是为了探究Na2S2O3的还原性。2S2O3溶液的性质的知识。
HS2O3-+OH-。在溶液的pH=8时,pH试纸的颜色应该接近绿色。因此选项为D。因为Na2S2O3有还原性,氯水有氧化性,二者发生氧化还原反应:Na2S2O3+4Cl2+5H2O=2NaCl+2H2SO4+6HCl.产生SO42-。再加入BaCl2溶液时发生沉淀反应:SO42-+Ba2+="Ba" SO4↓。因此实验②、③的目的是为了探究Na2S2O3的还原性。2S2O3溶液的性质的知识。
本题难度:一般
3、选择题 .在容积为2 L的密闭容器中,有反应:mA(g)+nB(g) pC(g)+qD(g),
pC(g)+qD(g),
经过5分钟达到平衡,此时,各物质的变化为:A减少了a mol·L-1, B的平均反应速率vB=a/15 mol·(L·min)-1,C增加了2a/3 mol·L-1,这时,若增加系统压强,发现A与C的百分含量不变,则m∶n∶p∶q为( )
A.3∶1∶2∶2
B.1∶3∶2∶2
C.1∶3∶2∶1
D.1∶1∶1∶1
参考答案:A
本题解析:mA(g)+nB(g) pC(g)+qD(g)
pC(g)+qD(g)
△c: a 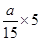 2a/3
2a/3
故m∶n∶p=3:1:2,又因为平衡时增加压强,A、C的百分含量均不变,说明平衡并没有移动,则两边气体的系数和相等,则m∶n∶p∶q=3∶1∶2∶2
本题难度:一般
4、选择题 下列相关实验的现象或结论正确的是
A.向NaAlO2溶液中滴入NaHCO3溶液有白色沉淀,则AlO2-结合质子能力比CO32-强
B.向少量的稀溴水中滴入饱和苯酚溶液立即产生白色沉淀
C.检验废铁屑溶于盐酸后所得的溶液中是否含有Fe2+,可向其中加入酸性KMnO4溶液,根据其是否褪色进行判断
D.加入硫酸铜可使锌与稀硫酸的反应速率加快,说明Cu2+具有催化作用
参考答案:A
本题解析:A、发生的反应AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-,利用了酸性强的制取酸性弱的,即AlO2-结合质子能力比CO32-强,正确;B、苯酚与浓溴水反应,而不是稀溴水,同时苯酚是少量,溴水是过量的,否则看不到沉淀,错误;C、根据现象不能判断溶液是否有Fe2+,因为KMnO4能与HCl发生氧化还原反应,溶液的颜色褪去,错误;D、Cu2+的氧化性大于H+,Zn与Cu2+发生置换反应:Zn+Cu2+=Zn2++Cu,铜附着在锌上形成原电池,加快反应的进行,不是催化作用,错误。
考点:考查元素及其化合物的性质。
本题难度:一般
5、选择题 关于反应速率、反应限度的下列说法错误的是( )
A.其它条件不变时,升高温度化学反应速率加快
B.其它条件不变时,增大浓度化学反应速率加快
C.化学反应达到反应限度时,正反应速率和逆反应速率相等
D.化学反应达到反应限度时,反应物的浓度和生成物的浓度相同
参考答案:A.升高温度,活化分子百分数增大,反应速率增大,故A正确;
B.增大反应物浓度,单位体积的活化分子数目增大,反应速率增大,故B正确;
C.当正逆反应速率相等时,达到平衡状态,故C正确;
D.达到平衡状态时,各物质的浓度不变,但不一定相等,故D错误.
故选D.
本题解析:
本题难度:简单