时间:2021-02-18 04:42:58
1、计算题 (4分)一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,请回答下列问题:
(1)反应开始到10s,用X表示的反应速率为?
(2)反应的化学方程式为?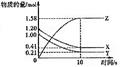
2、选择题 把4mol A和2.5mol B混合于2L密闭容器中,发生反应:3A(g)+2B(s)  xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是(? )
xC(g)+D(g),5min后反应达到平衡,容器内压强变小,测得D的平均反应速率为0.05mol?L-1?min-1 ,下列结论错误的是(? )
A.A的平均反应速率为0.15 mol?L-1?min-1
B.平衡时,C的浓度为0.25mol?L-1
C.B的平均反应速率为0.1 mol?L-1?min-1
D.平衡时,容器内压强为原来的0.875倍
3、填空题 (6分)氯酸钾和亚硫酸氢钠发生氧化还原反应生成Cl(-1价)和S(+6价)的速率如图曲线所示,已知ClO3-的氧化性随c(H+)的增大而增强,有关方程式为:
ClO3-+3 HSO3-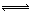 Cl-+3 H+ +3 SO42-
Cl-+3 H+ +3 SO42-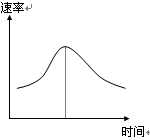
(1)反应开始时反应速率加快的原因是?;
(2)反应后期反应速率下降的原因是?。
4、填空题 亚硫酸钠和碘酸钾在酸性溶液中发生以下反应:
_____Na2SO3+____KIO3+____ H2SO4=____Na2SO4 +_____K2SO4+____ I2 +_____H2O
(1)配平上面的氧化还原反应方程式,将化学计量数填在空白处。
(2)其中氧化剂是_______,若反应中有5mol电子转移,则生成碘_______mol。
(3)该反应过程和机理较复杂,一般认为分以下①~④步反应:
①IO3-+SO32- =IO2-+SO42- (反应速率慢)
②IO2-+2SO32- =I-+2SO42- (反应速率快)
③5I-+6H++IO3-=3I2+3H2O (反应速率快)
④I2+SO32- +H2O=2I-+SO42- +2H+ (反应速率快)
根据上述条件推测,此反应总的反应速率由__________步反应决定(填上述四步反应的序号)。
(4)若预先加入淀粉溶液,由题述看必须在___________离子消耗完时,才会有使淀粉变蓝的现象产生。
5、选择题 下列条件下的反应,放出 最快的是:
最快的是:
| ? | 金属(粉末状)/mol | 酸的浓度和体积(mL) | 反应温度 | ||
| A | Mg | 0.1 | 3mol/LH2SO4 | 10 | 20℃ |
| B | Al | 0.1 | 3mol/LHCl | 10 | 20℃ |
| C | Zn | 0.1 | 3mol/LCH3COOH | 10 | 20℃ |
| D | Fe | 0.1 | 6mol/LHNO3 | 10 | 20℃ |