时间:2021-02-18 04:40:06
1、选择题 下列关于强、弱电解质的叙述正确的是
参考答案:
本题解析:
本题难度:一般
2、选择题 某合作学习小组的同学对冰醋酸在25℃下的稀释过程,有如下思辨,你认为不正确的是( )
A.醋酸的电离常数不变
B.溶液中c(H+)持续增大
C.pH先变小后增大
D.醋酸的分子数不断减少
参考答案:B
本题解析:
本题难度:一般
3、选择题 常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是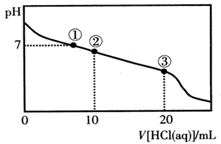
A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH)
C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)
D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)
参考答案:C
本题解析:A.点①所示溶液中pH=7,则:c(H+)=c(OH-);根据物料守恒可得c(Na+)=c(Cl-)+c(CH3COO-).盐的电离远大于弱电解质水的电离,因此微粒关系是c(Na+)=c(Cl-)+c(CH3COO-)>c(H+)=c(OH-)。错误。B.点②所示溶液中,由于发生反应:CH3COONa+HCl= CH3COOH+NaCl.由于二者是以2:1物质的量关系混合的,所以反应后的溶液为CH3COONa、CH3COOH、NaCl按照1:1:1的物质的量关系混合。由于CH3COOH的电离作用大于CH3COO-的水解作用,所以c(CH3COO-) >c(CH3COOH), c(CH3COO-) > c(Cl-);根据物料守恒可得c(Na+) >c(CH3COO-)。因此微粒的关系为c(Na+)>c(CH3COO-) >c(Cl-)>c(CH3COOH)。错误。C.点③所示溶液中恰好发生反应CH3COONa+HCl= CH3COOH+NaCl。得到的溶液为CH3COOH和NaCl的混合溶液。由于CH3COOH要发生电离作用,所以c(Na+)>c(CH3COOH);在溶液中除了醋酸电离产生H+外,还存在水的电离平衡,因此c(H+)>c(CH3COO-);但是醋酸是弱酸,电离程度是微弱的,因此c(CH3COOH)>c(H+)。故微粒关系为: c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-)。正确。D.根据物料守恒可得: c(Na+)=c(CH3COO-)+c(CH3COOH)。因此比可能出现c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH)。错误。
本题难度:一般
4、选择题 若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能是
[? ]
A.生成了一种强酸弱碱盐
B.弱酸溶液和强碱溶液反应
C.强酸溶液和弱碱溶液反应
D.一元强酸溶液和一元强碱溶液反应
参考答案:B
本题解析:
本题难度:一般
5、选择题 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示.下列说法不正确的是( )
A.在0点时,醋酸不导电
B.a、b、c三点,a点时醋酸溶液中H+浓度最小
C.b点时,醋酸电离程度最大
D.可通过微热的方法使c点溶液中c(CH3COO-)增大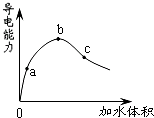
参考答案:A.在O点时,冰醋酸中不存在自由移动的离子,所以不导电,故A正确;
B.溶液的导电能力越大,溶液中存在的离子浓度越大,a、b、c三点,a点溶液导电能力最小,所以a点时醋酸溶液中H+浓度最小,故B正确;
C.醋酸的浓度越小,其电离程度越大,a、b、c三点,c点溶液的体积增大,则c点醋酸的电离程度最大,故C错误;
D.醋酸的电离是吸热反应,升高温度促进醋酸电离,所以可以通过微热的方法使c点溶液中c(CH3COO-)增大,故D正确;
故选C.
本题解析:
本题难度:一般