时间:2021-02-18 04:39:24
1、选择题 下列实验没有错误的是( )
A.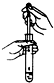
向试管中添加液体
B.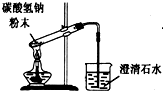
碳酸氢钠受热分解
C.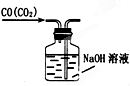
除去CO气体中的CO2气体
D.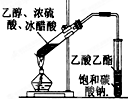
乙醇乙酸的制备
参考答案:A.图中胶头滴管伸入试管内,故造成后果为:会沾污滴管或造成药品的污染,故A错误;
B.给试管中的固体加热,试管口需要略向下倾斜,以防冷凝水倒流引起试管炸裂,故B错误;
C.洗气时导管应长进短出,否则会将液体排出,故C错误;
D.实验操作正确,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 下列物质与常用危险化学品的分类不对应的是
A.KMnO4——氧化剂
B.Na——遇湿易燃物品
C.浓硫酸——易爆品
D.KOH——腐蚀品
参考答案:C
本题解析:浓硫酸为腐蚀品,故C错误。
本题难度:简单
3、选择题 下列装置或操作的叙述中错误的是?
A.①可以用于利用铜与盐酸反应制取氯化铜溶液
B.②可以用于比较碳酸钠与碳酸氢钠的热稳定性
C.③可以从海水中提取淡水
D.④可以用于稀释浓硫酸
参考答案:D
本题解析:稀释浓硫酸应在烧杯中进行操作,而不能在量筒中,D不正确,其余都是正确的,答案选D。
本题难度:一般
4、填空题 为了测定含有H2C2O4·2H2O、KHC2O4和K2SO4的试样中各物质的质量分数,进行如下实验:
①称取6.0 g试样,加水溶解,配成250 mL试样溶液。
②用酸式滴定管量取25.00 mL试样溶液放入锥形瓶中,并加入2~3滴酚酞试液,用0.2500 mol/L NaOH溶液滴定,消耗NaOH溶液20.00 mL。
③再取25.00 mL试样溶液放入另一锥形瓶中,用0.1000 mol/L的酸性高锰酸钾溶液滴定,消耗高锰酸钾溶液16.00 mL。
回答下列问题:
(1)已知:0.10 mol/L KHC2O4溶液pH约为3,其中含碳元素的粒子浓度由大到小的顺序为?。
(2)步骤①所需要的玻璃仪器有烧杯、玻璃棒、?。
(3)完成并配平下列离子方程式:?C2O42-+?MnO4-+?H+=?CO2+?Mn2++???
(4)滴定时边滴边摇动锥形瓶,眼睛应观察?。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则测得的H2C2O4·2H2O的质量分数?。(填“偏大”、“偏小”或“无影响”)
(6)步骤③中判断滴定终点的方法是?。
(7)试样中H2C2O4·2H2O的质量分数为?。
参考答案:(12分) (1) c(HC2O4-)>c(C2O42-)>c(H2C2O4) (2分)
(2)胶头滴管、250 mL容量瓶(2分)、(量筒)
(3) 5,2,16? 10,2,8H2O(2分) ?(4) 锥形瓶中溶液颜色变化(1分)
(5) 偏小(1分)? (6) 溶液由无色变成浅紫红色,且半分钟内不褪色(1分)?(7) 21%(3分)
本题解析:(1)已知0.10 mol/L KHC2O4溶液pH约为3,溶液显酸性,这说明HC2O4-的电离程度大于HC2O4-的水解程度。由于不论是水解,还是电离,程度都是很小的,所以溶液中含碳元素的粒子浓度由大到小的顺序为c(HC2O4-)>c(C2O42-)>c(H2C2O4)。
(2)实验室配成250 mL试样溶液需要的仪器主要有烧杯、玻璃棒、胶头滴管和250ml容量瓶。
(3)根据反应式可知,C2O42-中碳元素的化合价从+3价升高到+4价,失去1个电子。MnO4-中Mn元素的化合价从+7价降低到+2价,得到5个电子,所以根据电子得失守恒可知,还原剂C2O42-与氧化剂MnO4-的物质的量之比是5:2,然后根据原子守恒可知,反应中还有水生成,所以配平后的离子方程式为5C2O42-+2MnO4-+16H+=10CO2+2Mn2++8H2O。
(4)滴定实验中准确判断终点是实验的关键,所以滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中溶液颜色变化。
(5)步骤②中量取试样溶液时,酸式滴定管用蒸馏水洗过后没有润洗,则导致溶液额浓度被稀释,所以消耗氢氧化钠溶液的体积减少,所以测得的H2C2O4·2H2O的质量分数偏小。
(6)由于酸性高锰酸钾溶液在溶液中显紫红色,所以步骤③中判断滴定终点的方法是溶液由无色变成浅紫红色,且半分钟内不褪色。
(7)设H2C2O4·2H2O、KHC2O4的物质的量分别是x 和y。25ml溶液消耗氢氧化钠的物质的量=0.02000L×0.2500 mol/L=0.005000mol,则250ml溶液消耗氢氧化钠的物质的量=0.005000mol×10=0.05000mol,则2x+y=0.05000mol。25ml溶液消耗高锰酸钾的物质的量=0.1000 mol/L×0.01600L=0.001600mol,所以250ml溶液消耗高锰酸钾的物质的量=0.001600mol×10=0.01600mol,则根据电子得失守恒可知,2x+2y=0.01600mol×5=0.08000mol,解得x=0.01000mol、y=0.03000mol,所以试样中H2C2O4·2H2O的质量分数为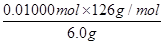 ×100%=21%。
×100%=21%。
本题难度:一般
5、实验题 NaCl在生活、生产和科研中都有广泛的用途。
I. 从海水中提取的粗盐含有Ca2+、Mg2+、SO4-等离子,为制备精盐可使用以下四种试剂:①Na2CO3溶液?②BaCl2溶液?③NaOH溶液?④盐酸(用于沉淀的试剂均稍过量)。
(1)加入试剂的合理顺序是________(填选项)。
a. ①②③④? b. ③①②④? c. ②①③④? d. ③②①④
(2)加入过量Na2CO3溶液的作用是________________。
II. 实验室要配制100 mL 0.2 mol·L-1 NaCl溶液。
(1)用托盘天平称氯化钠固体的质量是________g。
(2)配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和________。
(3)下列操作中,可能造成所配制溶液的浓度偏低的是________(填选项)。
a. 没有洗涤烧杯和玻璃棒? b. 定容时,俯视刻度线
c. 洗涤后的容量瓶中残留少量蒸馏水
参考答案:(7分)Ⅰ. (1)cd(2分)?(2)除净Ca2+,除去过量的Ba2+(2分)
Ⅱ. (1)1.2(1分,答1.17不给分)?(2)100 mL容量瓶(1分)?(3)a(1分)
本题解析:Ⅰ. (1)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后加入盐酸酸化。但用于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,因此正确的答案选cd。
(2)根据以上分析可知,加入过量Na2CO3溶液的作用是除净Ca2+,除去过量的Ba2+。
II. (1)需要氯化钠的质量是0.1L×0.2mol/L×58.5g/mol=1.17g。由于托盘天平只能读数到0.1g,所以用托盘天平称氯化钠固体的质量是1.2g。
(2)配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和100ml容量瓶。
(3)根据c=n÷V可知,没有洗涤烧杯和玻璃棒,则n值减小,浓度偏低;定容时,俯视刻度线,则V减小,浓度偏高;洗涤后的容量瓶中残留少量蒸馏水,对实验结果不影响,答案选a。
点评:该题是中等难度实验题的考查,试题基础性强,旨在巩固学生的基础,提高学生的实验能力,有利于培养学生规范严谨的实验设计能力和动手操作能力,有助于提升学生的学科素养。该题的难点是误差分析。
本题难度:一般