时间:2020-08-23 07:53:19
1、选择题 下列说法中正确的是( )
A.将AlCl3溶液、Na2SO3溶液蒸干并灼烧可分别得到Al2O3、Na2SO3
B.在溶液的稀释过程中,离子浓度有的可能增大,有的可能减小,有的可能不变
C.0.lmol/LCH3COOH溶液在稀释过程中
| c(H+) c(CH3C00H) |
参考答案:B
本题解析:
本题难度:一般
2、选择题 与纯水的电离相似,液氨中也存在着微弱的电离:2NH3?NH4++NH2-据此判断以下叙述中错误的是( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中c(NH4+)?c(NH2-)是一个常数
C.液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-)
D.只要不加入其他物质,液氨中c(NH4+)=c(NH2-)
参考答案:A.液氨电离中存在电离平衡,所以液氨中含有?NH3、NH4+、NH2-?等粒子,故A正确;
B.液氨中?c?(NH4+?)与?c?(NH2-?)的乘积只与温度有关,与溶液的浓度无关,所以只要温度一定,液氨中?c?(NH4+?)与?c?(NH2-?)的乘积为定值,故B正确;
C.液氨的电离是微弱的,所以液氨电离达到平衡状态时,c?(NH4+?)=c?(NH2-?)<c?(NH3?),故C错误;
D.只要不破坏氨分子的电离平衡,液氨电离出的NH4+?和NH2-?的物质的量就相等,因为溶液的体积相等,所以c?(NH4+?)=c?(NH2-?),故D正确;
故选C.
本题解析:
本题难度:简单
3、选择题 室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH-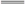 Al(OH)3↓
Al(OH)3↓
B.其溶液的pH=13
C.用适量水稀释后,NH3·H2O电离度和溶液pH都增大
D.加水稀释后,溶液中c(NH4 +)·c(OH-)变小
参考答案:D
本题解析:A.一水合氨是弱碱,不能写成离子形式。其与AlCl3溶液发生反应的离子方程式为Al3++3NH3·H2O= NH4++Al(OH)3↓。错误。B. 一水合氨是弱碱,在溶液中存在电离平衡:NH3·H2O NH4++OH-。c(OH-)<0.10 mol/L,其溶液的pH<13.错误。C.用适量水稀释后,NH3·H2O的电离平衡正向移动,所以电离度增大。由于稀释作用大于平衡移动使离子浓度增大的趋势,所以c(OH-)减小,溶液pH减小。错误。D.加水稀释后,溶液中c(NH4 +)、c(OH-)都减小,所以c(NH4 +)·c(OH-)变小。正确。
NH4++OH-。c(OH-)<0.10 mol/L,其溶液的pH<13.错误。C.用适量水稀释后,NH3·H2O的电离平衡正向移动,所以电离度增大。由于稀释作用大于平衡移动使离子浓度增大的趋势,所以c(OH-)减小,溶液pH减小。错误。D.加水稀释后,溶液中c(NH4 +)、c(OH-)都减小,所以c(NH4 +)·c(OH-)变小。正确。
本题难度:一般
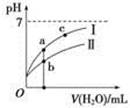
4、选择题 已知:下表为25 ℃时某些弱酸的电离平衡常数。图像表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是?
| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
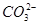
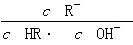 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)参考答案:C
本题解析:根据表中电离常数可知:酸性由强至弱的顺序为CH3COOH>H2CO3>HClO>HCO,结合质子的能力由大到小的顺序为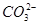 >ClO->
>ClO->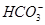 >CH3COO-。A项,ClO-的水解程度大于CH3COO-的水解程度,同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系应是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),错误;B项,
>CH3COO-。A项,ClO-的水解程度大于CH3COO-的水解程度,同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系应是c(Na+)>c(CH3COO-)>c(ClO-)>c(OH-)>c(H+),错误;B项,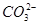 结合质子的能力大于ClO-结合质子的能力,离子方程式应为ClO-+CO2+H2O=HClO+
结合质子的能力大于ClO-结合质子的能力,离子方程式应为ClO-+CO2+H2O=HClO+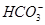 ,错误;C项,
,错误;C项,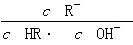 分子、分母同乘以溶液中c(H+),得
分子、分母同乘以溶液中c(H+),得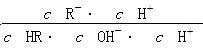 ,该式即为K电离/Kw,温度相同则该式的值相等,正确;D项,CH3COOH的酸性强于HClO,pH相同时,HClO的浓度大于CH3COOH的浓度,错误。
,该式即为K电离/Kw,温度相同则该式的值相等,正确;D项,CH3COOH的酸性强于HClO,pH相同时,HClO的浓度大于CH3COOH的浓度,错误。
本题难度:一般
5、选择题 (2009深圳一模)常温离子液体(又称常温熔融盐),是当前化学研究的热点和前沿。1914年报道的第一种离子液体硝酸乙基铵〔(C2H5NH3)NO3〕的熔点为12℃。已知C2H5NH2的化学性质与NH3相似,下列有关硝酸乙基铵的说法正确的是
A.该离子液体可以作为电池的电解质
B.硝酸乙基铵水溶液呈碱性
C.(C2H5NH3)NO3能与NaOH反应产生NH3
D.硝酸乙基铵水解的离子方程式或表示为:C2H5NH3++H2O=C2H5NH2+H3O+
参考答案:A
本题解析:该离子液体如果可以传递电子就可以作为电池的电解质;硝酸乙基铵与硝酸铵应相似,呈酸性,B错;C应该生成C2H5NH2而不是氨气;D 中应该为C2H5NH2﹒H2O和氨水相似。
本题难度:简单