时间:2020-08-23 07:53:19
1、简答题 将某一元酸HA溶液与NaOH溶液等体积混合:
(1)若c?(HA)=c?(NaOH)=0.lmol/L,测得混合后溶液的pH>7.
①不能证明HA是弱电解质的方法是______
A.测得0.1mol/L?HA的pH>l
B.测得NaA溶液的pH>7
C.pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
②混合溶液中,关系式一定正确的是______
A.c(A-)>c(Na+)>c(OH-)>c(H+)?B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L?D.c(?HA)+c(?H+)=c(OH-)
③若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC,则相同pH的?①NaA溶液?②Na2B溶液?③NaHB溶液?④NaC溶液,其物质的量浓度由大到小的顺序为______(填序号).
(2)若c(?HA)=c(NaOH)=0.1mol/L,测得混合后溶液的pH=7.
①现将一定浓度的HA溶液和0.1mol/L?NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则HA溶液的物质的量浓度为______.
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是______.
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
(3)若c(HA)=0.04mol/L,c(NaOH)═0.02mol/L.
①若HA为HCN,该溶液显碱性,则溶液中c(Na+)______c?(CN-)(填“小于”、“等于”或“大于”),得出该结论的依据是______.
②若HA为CH3COOH,该溶液显酸性,溶液中所有离子按浓度由大到小排列的顺序是______.
③若HA为强酸,99℃时(Kw=10-12),将两种溶液等体积混合后,溶液中由水电离出的H+浓度为______mol/L(假设混合后溶液体积为两溶液体积之和).
2、选择题 将0.1mol/L的CH3COOH加水稀释,有关稀释后醋酸溶液的说法中,错误的是( )
A.电离程度增大
B.溶液中离子总数增多
C.溶液导电性增强
D.溶液中醋酸分子减少
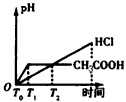
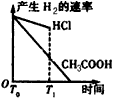
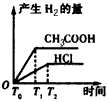
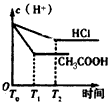
3、选择题 在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是
[? ]
4、选择题 室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合后的体积变化)( )
| 序号 | ① | ② | ③ | ④ |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
5、填空题 常温下,有浓度均为0.1 mol/L 的4种溶液:①盐酸;②硫酸;③醋酸;④氢氧化钡。(注:忽略溶液混合时 体积的变化)
(1)将上述溶液两两等体积混合后,溶液pH=7的组合有(填序号)_________。
(2)醋酸钡是易溶于水的强电解质。将③与④等体积混合,所得溶液中离子浓度由大到小的顺序是_____。