时间:2020-08-23 07:43:21
1、实验题 根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量么 ?(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量
?(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量 m(H20),由此计算
m(H20),由此计算 。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4C1与Ca(OH)2的量足以产生使CuO完全还原的氨气):
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为________________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→______________________________;
(3)在本实验中,若测得m(CuO)=" a" g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大 的是_______________ (填序号);
的是_______________ (填序号);
1Cu0未完全起反应?② CuO不 干燥
干燥
3Cu0中混有不反应的杂质?④碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定_______________和_______________,或__________ _____和_______________达到实验目的。
_____和_______________达到实验目的。
2、实验题 某同学为了探究该校化学实验室的一种黑色粉末和一瓶标签破损的无色溶液,可能是什么物质,大胆猜想并设计实验进行验证。
[发现问题]当把黑色粉末与无色溶液混合时即产生气泡。[查阅资料]中学化学实验室常见的黑色粉末有氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉等。
[提出假设]黑色粉末是?,无色溶液是?。(只写一种假设)
[设计实验]
| 实验操作 | 实验现象 | 实验结论 |
| ? | ? | ? |
3、实验题 工业碳酸钠由于在生产过程中原料盐和工艺等的原因,常会含有Na2SO4、NaCl中的一种或两种杂质。现有工业碳酸钠样品,某化学兴趣小组就工业碳酸钠中是否含有这两种杂质进行探究。 实验室有以下的仪器和药品可供使用:
实验室有以下的仪器和药品可供使用:
烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹:1.0 mol·L-1H2SO4、1.0 mol·L-1HNO3、1.0mol·L-1HCl、NaOH稀溶液、0.1 mol·L-1AgNO3、0.1 mol·L-1BaCl2、0.1 mol·LBa(NO3)2、蒸馏水。以下是部分实验探究过程:
1)提出假设:
假设1?白色粉末为 ?的混合物;
假设2?白色粉末为 ?的混合物;
假设3?白色粉末为碳酸钠、硫酸钠、氯化钠的混合物;
2)基于假设设计实验方案
3)根据实验方案进行实验 请回答:
请回答:
(1)某同学取少许样品于试管中,加适量蒸馏水溶解,向试管中滴入0.1 mol·L-1的BaCl2溶液,有白色沉淀产生,他认为样品中含有Na2SO4。你认为他的结论是 (填“对的”或“错的”),原因是:?。
(2)设计实验方案
基于工业碳酸钠中两种杂质均存在这一假设,设计出实验方案(在答题卡上作答)。
| 编号 | 实验操作 | 预期现象和结论 |
| ① |   | 有无色气体产生,说明样品中含有Na2CO3。 若无气体产生,说明样品中没有Na2CO3。 |
| ② |   | ? |
| ③ |   | ? |
4、实验题 (7分)实验室利用如图装置进行中和热的测定,请回答下列问题: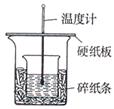
(1)在操作正确的前提下,提高中和热测定准确性的关键是?
(2)做1次完整的中和热测定实验,温度计需使用?次,某同学为了省去清洗温度计的麻烦,建议实验时使用两支温度计分别测量酸和碱的温度,你是否同意该同学的观点,为什么??
(3)请为本实验设计数据记录表格:
5、实验题 (15分)“旺旺雪饼”袋内有一个小纸袋,上面写着“干燥剂,主要成分是生石灰”。为此我对干燥剂的有关问题进行相关探究:
(1)问题1:为什么生石灰(CaO)可作干燥剂?(用化学方程式表示)????。
(2)我又对它作了一系列探究,获得较多收益,其有关实验方案如下:
| 问题与猜想 | 实验步骤 | 实验现象 | 实验结论 |
| 问题2:小纸袋中的物质 能否继续作干燥剂? | 取足量小纸袋中固体放入烧杯中,加入适量水,触摸杯壁。 | ? | 不能作 干燥剂 |
| 问题3:我猜想变质后的物质可能是碳酸钙,该如何验证我的猜想? | ? | ? | ?该干燥剂样品中有碳酸钙 |
 .
.