时间:2020-08-23 07:39:52
1、实验题 (9分)I.某氯化钠固体样品中含有少量的硫酸钠和碳酸钠杂质,按下列流程进行净化,步骤如下(用于沉淀的试剂稍过量):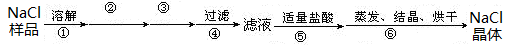
步骤②③依次加入的试剂是?。
II.海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取单质碘(I2)的流程如下: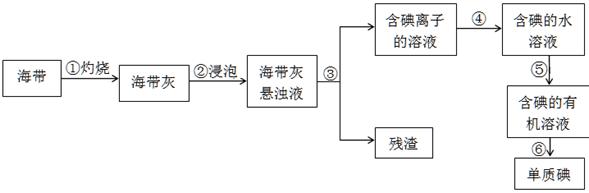
(1)①~⑥中发生化学变化的是?。
(2)步骤⑤所使用的玻璃仪器名称是?,选择的有机试剂可以是?。
A.酒精? B.四氯化碳? C.醋酸? D.苯
(3)步骤⑥从含碘的有机溶液中提取碘并回收有机溶剂,还需要经过蒸馏(如下图所示)。冷水的流向为?到?。(填A、B)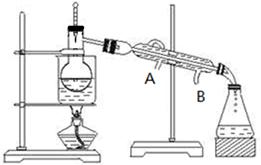
2、填空题 实验室需要0.1 mol·L-1NaOH溶液450mL,根据溶液配制情况回答下列问题:
(1)实验中除了托盘天平、烧杯、500mL容量瓶外还需要的其它仪器有:?
(2)根据计算得知,所需NaOH的质量为?g。
(3)如果出现以下操作,能使所配浓度偏大的是(填写字母)?
A.称量用了生锈的砝码;
B.将NaOH放在纸张上称量
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.往容量瓶转移时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯? F.定容时仰视刻度线
G.容量瓶未干燥即用来配制溶液H.定容后塞上瓶塞颠倒摇匀,正立静置后,液面不到刻度线,再加水至刻度线。
3、选择题 进行中和滴定时,事先不应用所盛装溶液润洗的仪器是(?)
A.酸式滴定管
B.锥形瓶
C.量筒
D.碱式滴定管
4、选择题 配制一定物质的量浓度的NaOH溶液,下列操作正确的是
A.将NaOH固体直接放在托盘天平的托盘上称量
B.将NaOH固体加水溶解,待所得溶液冷却到室温后,再转移至容量瓶中
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线
5、选择题 正确的实验操作是实验成功的重要因素,下列实验操作错误的是( )
A.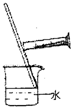
浓硫酸的稀释
B.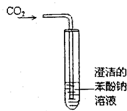
碳酸、苯酚酸性强弱比较
C.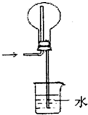
氯化氢气体的吸收
D.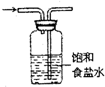
除去氯气中氯化氢