时间:2020-08-23 07:25:46
1、实验题 随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取m g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加入苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl的体积V cm3。
请完成下列问题:
(1)步骤①中仪器最好使用_________(填序号)。
A.量筒
B.烧杯
C.容量瓶
D.试管
(2)步骤②中用酸式滴定管还是用碱式滴定管_________,理由_________。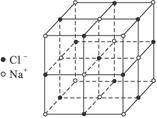
(3)能否用水代替苯_________,理由是_________。
(4)已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为a cm(如右图),用上述测定方法测定的阿伏加德罗常数NA的表达式为_______________。
参考答案:(1) C(2)酸式滴定管苯可将碱式滴定管的橡胶溶解变形? (3)不能? NaCl易能溶于水,不能准确测定NaCl固体的体积? (4)

本题解析:定量实验是近年化学实验考查的趋向,本题以阿伏加德罗常数的测定为基础,重点考查实验基本技能和计算能力。解题的关键是分析清楚实验原理,实验成功的关键是准确测定NaCl的体积,用容量瓶作为定容容器,其精确度高(0.01 mL),然后向其中加入一定体积的苯(通过酸式滴定管读取)至容量瓶的刻度,两体积差即为NaCl固体的体积;根据NaCl晶体可知:一个NaCl晶胞如右图:
由于在晶体内部离子共用,相当于一个晶胞中含Na+、Cl-的个数分别为 、
、 。
。
体积?质量
2NA a3 cm3? 58.5 g
V mL?m g
所以得NA= 。
。
本题难度:简单
2、简答题 用14.2g无水Na2SO4配制成500mL溶液,其物质的量浓度为多少?若从中取出10mL,含溶质Na2SO4的质量是多少克?
参考答案:n(Na2SO4)=14.2g142g/mol=0.1mol,
c(Na2SO4)=0.1mol0.5L=0.2mol/L,
若从中取出10mL,含溶质Na2SO4的质量是:m=n?M=0.01L×0.2mol/L×142g/mol=0.284g,
答:物质的量浓度为0.2mol/L,若从中取出10mL,含溶质Na2SO4的质量是0.284g.
本题解析:
本题难度:一般
3、选择题 下列叙述正确的是( )
A.1 mol H2O的质量为18g/mol
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.标准状况下,1 mol任何物质体积均为22.4L
参考答案:C
本题解析:A 错误,1 mol H2O的质量为18g
B 错误,CH4的摩尔质量为16g/mol
C 正确,3.01×1023个SO2为0.5mol,质量为32g
D 错误,标准状况下,1 mol任何气体的体积均为22.4L
本题难度:一般
4、选择题 NA表示阿伏加德罗常数的值,下列叙述正确的是
A.常温下,30 L pH=11的Na2CO3溶液中含有的OH-数为0.03NA
B.用含有0.1 mol FeCl3的饱和溶液制得的氢氧化铁胶体中,胶粒数等于0.1NA
C.25℃时,pH=13的1LBa(OH)2溶液中含有的OH-数为0.2NA
D.100 mL 12 mol·L-l浓盐酸与足量MnO2加热反应,产生的氯气分子数为0.3NA
参考答案:A
本题解析:常温下,30 L pH=11的Na2CO3溶液中含有的OH-的物质的量为10-3×30L=0.03mol,所以OH-的个数为0.03NA,A选项正确;胶体粒子是氢氧化铁形成的集合体,微粒数一定小于0.1NA,故B错误;25℃时,pH=13的1LBa(OH)2溶液中含有的OH-的物质的量为10-1×1L=0.1mol,所以OH-的个数为0.1NA,C选项错误;依据化学方程式 MnO2+4HCl MnCl2+Cl2↑+H2O,100 mL×12 mol·L-l当1.2molHCl完全反应时可生成0.3NACl2,但随着反应的进行,盐酸的浓度逐渐降低,稀盐酸的还原性较弱,与二氧化锰不反应,则生成的氯气的物质的量小于0.3NA,D选项错误。
MnCl2+Cl2↑+H2O,100 mL×12 mol·L-l当1.2molHCl完全反应时可生成0.3NACl2,但随着反应的进行,盐酸的浓度逐渐降低,稀盐酸的还原性较弱,与二氧化锰不反应,则生成的氯气的物质的量小于0.3NA,D选项错误。
本题难度:一般
5、选择题 在100g浓度为18mol/L、密度为ρ (g/cm3)的浓硫酸中加入一定量的水稀释成9mol/L的硫酸,则加入水的体积为
A.小于100mL
B.等于100mL
C.大于100mL
D.等于100/p mL
参考答案:A
本题解析:
考点:物质的量浓度的相关计算.
专题:物质的量浓度和溶解度专题.
分析:根据稀释前后溶质的质量不变来列式计算及硫酸的浓度越大,密度越大,w越大来分析,注意水的密度与硫酸的密度小.
解答:解:稀释前后溶质的质量不变,设加水的质量为x,
则100g×w1=(100g+x)×w2,
18mol?L-1的浓硫酸加到一定量的水中稀释成9mol?L-1的硫酸,
由c=1000ρw/M及硫酸的浓度越大,密度越大,
则w1>2w2,
所以100+x/100<2,
解得x<100g,
又水的密度约为1g/mL,
则加水的体积小于100mL,故选A。
点评:本题考查物质的量浓度的计算,难度较大,学生容易忽略密度与浓度、质量分数的关系,水的密度与硫酸的密度大小。
本题难度:一般