时间:2020-08-23 07:18:45
1、选择题 已知反应:
①101KPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mol
下列结论正确的是
[? ]
A.碳的燃烧热大于110.5 kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为114.6kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1 mol水,也放出57.3 kJ热量
参考答案:A
本题解析:
本题难度:简单
2、选择题 下列液体pH>7的是( )
A.人体血液
B.蔗糖溶液
C.橙汁
D.胃液
参考答案:A
本题解析:人体血液pH大于7,蔗糖溶液pH=7,橙汁和胃液的pH小于7,答案选A。
点评:该题是常识性知识的考查,试题贴近生活实际,有利于调动学生的学习兴趣。本题难度不大,记住即可。
本题难度:简单
3、选择题 下图是向100 mL的盐酸中逐渐加入NaOH溶液时,溶液的pH变化图。根据图所得结论正确的是?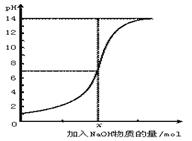
A.原来盐酸的物质的量浓度为1 mol·L-1?
B.原来盐酸的物质的量浓度为0.1 mol·L-1?
C.x处为含NaOH0.1 mol的溶液
D.x处为含NaOH0.001 mol的溶液
参考答案:B
本题解析:在没有加入氢氧化钠之前,盐酸的pH=1,所以其浓度是0.1mol/L的,A不正确,B正确。二者恰好反应时,溶液显中性,需要氢氧化钠是0.01mol,所以选项CD都是错误的,答案选B。
本题难度:一般
4、选择题 下列操作后,溶液pH减小的是?(?)
A.适当升高Na2CO3溶液的温度
B.往氨水中加入NH4Cl固体
C.往氨水中加入CaCO3固体
D.用石墨作电极电解NaCl溶液
参考答案:B
本题解析:略
本题难度:简单
5、选择题 新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源的是
A.石油
B.太阳能
C.煤
D.天然气
参考答案:B
本题解析:煤、石油和天然气都是化石燃料,不是新能源,太阳能属于新能源,答案选B。
点评:新能源是相对于常规能源说的,一般具有资源丰富、可以再生,没有污染或很少污染等。常见的新能源有太阳能、风能、生物质能、氢能、地热能和潮汐能等许多种,需要学生熟练记住。
本题难度:简单