时间:2020-08-23 06:59:33
1、填空题 用NaOH固体配制250mL0.1?mol·L-1溶液过程中,需用NaOH固体______g? 配制过程中如果出现下列情况,会使溶液物质的量浓度如何变化?(填“偏高”、“偏低”或“不变”)
⑴?所用NaOH已潮解,则结果___________;?
⑵?转移时未洗涤烧杯,则结果___________;
⑶?所用容量瓶未干燥,则结果___________;?
⑷?定容时俯视,则结果____________;
⑸?称量时砝码和药品放反了(5克以下使用游码),则结果____________。
参考答案:1?; (1)偏低 ;(2)偏低 ;(3)无影响 ;(4)偏高 ;(5)偏低
本题解析:
本题难度:一般
2、简答题 实验室使用的浓盐酸的溶质质量分数一般为36.5%,密度1.19g/cm3.
(1)将______升氯化氢(标准状况)通入1.00L水中可以得到36.5%的浓盐酸?
(2)该浓盐酸的物质的量浓度为______.
参考答案:(1)令需要氯化氢的体积为VL,则HCl的物质的量为VL22.4L/mol=V22.4mol,故HCl的质量为V22.4mol×36.5g/mol=36.5V22.4g,1.00L水的质量为1L×1000g/L=1000g,故溶液的质量为(1000+36.5V22.4)g,故(1000+36.5V22.4)g×36.5%=36.5V22.4g,解得:V=352.8L,
故答案为:352.8;
(2)质量分数为36.5%,密度1.19g/cm3的浓盐酸的物质的量浓度为1000×1.19×36.5%36.5mol/L=11.9mol/L,
答:该浓盐酸的物质的量浓度为11.9mol/L.
本题解析:
本题难度:一般
3、填空题 硫磺在科学技术和生产中有重要的应用。石硫合剂是一种很好的植物杀虫剂,它是硫磺与石灰、水等反应所得――由多硫化钙[ CaSx(x≤5)]、硫代硫酸钙组成的混合物。不同比例的石灰和硫磺在水溶液中反应,可生成不同的多硫化钙和硫代硫酸钙。如:
3Ca(OH)2+8S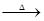 2CaS3+CaS2O3+3H2O;
2CaS3+CaS2O3+3H2O;
3Ca(OH)2+6S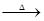 2CaS2+CaS2O3+3H2O等。
2CaS2+CaS2O3+3H2O等。
根据题意完成下列计算:
(1)、硫磺溶解在硫化钠溶液中生成一种多硫化物,该多硫化物中硫元素的质量分数为0.736,通过计算确定Na2Sx中x=?。
(2)、取某石硫合剂(假如只含两种含硫化合物)250mL(密度为1.12g/mL)通入足量CO2使其快速分解。原理如下:
Sx2-+2H2O+2CO2→(x-1)S↓+H2S↑+ 2HCO3-,S2O32- + H2O+CO2→HSO3-+HCO3-+S↓ 。
完全反应后共收集到气体1.12升(S·P·T)(忽略气体在溶液中的溶解),则该石硫合剂中多硫化钙的物质的量浓度为?;硫代硫酸钙的质量分数为?。(答案用小数表示,保留2位有效数字)
(3)、如果把生石灰、硫磺和水按质量比7:16:70的配比完全反应后,只生成两种含硫的化合物,则该石硫合剂中多硫化钙与硫代硫酸钙的物质的量之比是?;多硫化钙的化学式是?。
(4)、现有生石灰50.4g、硫磺96g、水504g恰好完全反应生成三种多硫化钙,除生成CaS4之外还有二种多硫化钙。请推算这二种多硫化钙可能的物质的量之比(写出推算过程)。
参考答案:(1)、4?(2分)?(2)、0.20 mol/L (2分)? 0.014?(2分)
(3)、2:1?(2分)? CaS5?(2分)
(4)、n(CaO)="50.4/56" =0.3mol? n(S)="96/32" =3mol?(1分)?
则 n[Ca(OH)2 ]: n(S) =" 3" : 10?由反应可知:3Ca(OH)2+10S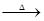 2CaSx+CaS2O3+3H2O
2CaSx+CaS2O3+3H2O
解之得:x="4" 即多硫化物中硫原子的平均值为4.?(1分)
故另两种多硫化物可能为:CaS2与CaS5或CaS3与CaS5。?(2分)
由 ?可知,n(CaS2):n(CaS5)=1:2;(1分)
?可知,n(CaS2):n(CaS5)=1:2;(1分)
由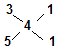 ?可知,n(CaS3):n(CaS5)=1:1?(1分)
?可知,n(CaS3):n(CaS5)=1:1?(1分)
其他和理解法也可以给分。
本题解析:(1). 硫元素的质量分数为0.736,则钠元素的质量分数为0.264,所以钠原子和硫原子的个数之比是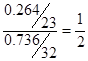 ,所以x=4.
,所以x=4.
(2)硫化氢是0.05mol,所以根据方程式可知,多硫化钙的物质的量是0.05mol,其浓度是0.05mol÷0.25L=0.20 mol/L。其中+CaS2O3的物质的量是0.05mol÷2=0.025mol,所以其质量分数是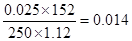 。
。
(3)生石灰、硫磺的质量比7:16,则物质的量之比是1︰4,即氢氧化钙和硫磺的物质的量之比是1︰4,所以方程式为3Ca(OH)2+12S 2CaSx+CaS2O3+3H2O,因此x=5。
2CaSx+CaS2O3+3H2O,因此x=5。
(4)n(CaO)="50.4/56" =0.3mol? n(S)="96/32" ="3mol"
则 n[Ca(OH)2 ]: n(S) =" 3" : 10?由反应可知:3Ca(OH)2+10S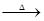 2CaSx+CaS2O3+3H2O
2CaSx+CaS2O3+3H2O
解之得:x="4" 即多硫化物中硫原子的平均值为4.
故另两种多硫化物可能为:CaS2与CaS5或CaS3与CaS5。
由 可知,n(CaS2):n(CaS5)=1:2;
可知,n(CaS2):n(CaS5)=1:2;
由 可知,n(CaS3):n(CaS5)=1:1
可知,n(CaS3):n(CaS5)=1:1
本题难度:一般
4、填空题 将3.22g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+,则需水的质量为?g。
参考答案:34.2
本题解析:3.22g芒硝的物质的量为3.22g/322(g/mol) =0.01mol
所以溶液中n(Na+)=2n(Na2SO4?10H2O)=0.01mol×2=0.02mol
每100个水分子中溶有1个钠离子,所以n(H2O)=100n(Na+)=2mol
0.01molNa2SO4?10H2O中含有水的物质的量为0.01mol×10=0.1mol
所以需要的水的物质的量为2mol-0.1mol=1.9mol
所以需要水的质量为1.9mol×18g/mol=34.2g
答:需要水的质量为34.2g.
点评:考查物质的量及有关浓度计算,难度中等,明确水的总的量减去Na2SO4?10H2O晶体中含有水的量为需要加入的水是解题关键。
本题难度:一般
5、选择题 阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
⑴.0.25molNa2O2中含有的阴离子数为0.5×6.02×1023?⑵.7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023?⑶.2.24LCH4中含有的原子数为0.5×6.02×1023
⑷.250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5×6.02×1023?⑸.1L 1mol·L―1的HAc溶液中含有6.02×1023个氢离子?⑹.18g D2O(重水)完全电解,转移
6.02×1023个电子?⑺.22.4L SO2气体,所含氧原子数为2×6.02×1023
⑻.14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023
A.2个
B.3个
C.5个
D.6个
参考答案:A
本题解析:⑴错,因为0.25molNa2O2中含有的阴离子0.25moL;⑵正确,n(SiO2)="7.5/60" mol=0.125mol,每摩尔SiO2含有共价键是(1×4+2×2)/2 moL=4mol, 7.5gSiO2晶体中含有的硅氧键数为0.125×4×6.02×1023=0.5×6.02×1023 ;⑶错,不知道气体的存在的条件,无法计算;⑷错,因为氨水中存在这如下平衡NH3 + H2O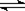 NH3·H2O
NH3·H2O 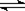 ?NH4++OH-? ;⑸错,因为Hac是弱电解质。⑹错,18g D2O的物质的量小于1mol,⑺错,因为不知道气体的存在条件;⑻正确,因为乙烯与丙烯的最简式都是CH2,1.4g乙烯与丙烯的混合物中相当于含有0.1molCH2。
?NH4++OH-? ;⑸错,因为Hac是弱电解质。⑹错,18g D2O的物质的量小于1mol,⑺错,因为不知道气体的存在条件;⑻正确,因为乙烯与丙烯的最简式都是CH2,1.4g乙烯与丙烯的混合物中相当于含有0.1molCH2。
本题难度:一般