时间:2020-08-23 06:55:42
1、选择题 能使水的电离平衡右移,且水溶液显碱性的离子是(? )
A.H+
B.OH-
C.Al3+
D.HCO3-
参考答案:D
本题解析:H+、OH-均抑制水的电离;Al3+、H2O3-均促进水的电离,且HCO3-水解溶液呈弱碱性。
本题难度:一般
2、选择题 25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3 kJ/mol、
2800 kJ/mol,则下列热化学方程式正确的是
[? ]
A.C(s)+1/2O2(g)=CO(g) △H= -393.5 kJ/mol
B.2H2(g)+O2(g)=2H2O(l) △H= +571.6 kJ/mol
C.CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H= -890.3 kJ/mol
D.C6H12O6(s) +6O2(g)=6CO2(g)+6H2O(l) △H= -2800 kJ/mol
参考答案:D
本题解析:
本题难度:简单
3、选择题 科学家预测“氢能”将是21世纪最理想的新能源。化学家提出“硫-碘热循环法”制氢气,总反应方程式为: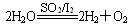 ,其循环过程分三步进行:
,其循环过程分三步进行:
(a) SO2+I2+2H2O=2HI+H2SO4 (b) 2HI=H2+I2 (c) 2H2SO4=2SO2+O2+2H2O。
下列分析不合理的是 (? )
A.由于硫酸很稳定,所以反应(c)最难进行
B.该循环过程不需加热,常温下就能进行
C.反应生成的SO2和I2可以循环使用
D.“硫-碘热循环法”耗能大,若利用太阳能,可大面积推广
参考答案:B
本题解析:由于硫酸很稳定,所以循环过程c反应很难进行,致使这个制氢气的总反应在常温下并不能进行,需要提供能量才可,故B描述不合理。
本题难度:一般
4、选择题 25 ℃时,水的电离达到平衡:H2O H++OH-
H++OH- 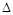 H>0,下列叙述正确的是( )
H>0,下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
参考答案:B
本题解析:加碱抑制水的电离,使水的电离平衡逆向移动,但c(OH-)增大,A项错误;硫酸氢钠电离出c(H+),使水的电离平衡逆向移动,但c(H+)增大,KW仅与温度有关,故KW不变,B项正确;C项中CH3COO-与水电离出的H+结合,使水的电离平衡正向移动,C项错误;将水加热促进水的电离,c(H+)增大,pH减小,D项错误。
本题难度:一般
5、选择题 下列说法正确的是(? )
A.酸式盐的pH均小于7
B.升高温度可以抑制水的电离
C.强电解质溶液导电能力强于弱电解质
D.水解反应是吸热反应
参考答案:D
本题解析:NaHCO3是酸式盐,但其pH大于7,故A错误;
水的电离是吸热的,则升温将促进水的电离,故B错误;
溶液的导电能力与溶液中离子浓度有关,而与电解质的强弱无关,故C错误;
水解反应是酸碱中和的逆反应,酸碱中和是放热的,则水解反应是吸热反应,故D正确;
本题难度:一般