时间:2020-08-23 06:55:42
1、选择题 下列说法正确的是
A.已知CO(g)的燃烧热ΔH=-283.0 kJ·mol-1,则表示CO燃烧热的热化学方程式为2CO(g)+O2(g)===2CO2(g) ΔH=-566.0 kJ/mol
B.等量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多。
C.H2(g)+F2(g)=2HF(g);ΔH1="a" kJ/mol;H2(g)+Cl2(g)=2HCl(g);ΔH2="b" kJ/mol ΔH1<ΔH2
D.C(s)+H2O(g) 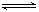 CO(g)+H2(g);ΔH>0,若平衡后再充入一定量水蒸气,则ΔH增大
CO(g)+H2(g);ΔH>0,若平衡后再充入一定量水蒸气,则ΔH增大
参考答案:C
本题解析:A.燃烧热是指一定条件下1mol 燃料完全燃烧生成稳定氧化物放出的热量,故其热化学方程式在书写时可燃物的化学计量数应为1,故A错误。B.等量的硫蒸气和硫固体的能量相比较硫蒸气的能量高,所以二者分别完全燃烧,前者放出的热量多。故B错误。C.H2(g)+F2(g)=2HF(g);ΔH1="a" kJ/mol;H2(g)+Cl2(g)=2HCl(g);ΔH2="b" kJ/mol 因ΔH1、ΔH2均为负值,所以ΔH1<ΔH2,故C正确。D.C(s)+H2O(g) 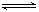 CO(g)+H2(g);ΔH>0,若平衡后再充入一定量水蒸气,平衡向右移动放出的热量增大,但ΔH不变,故D错误。
CO(g)+H2(g);ΔH>0,若平衡后再充入一定量水蒸气,平衡向右移动放出的热量增大,但ΔH不变,故D错误。
考点:了解热化学方程式的含义。了解焓变与反应热的含义。
点评:本题化学反应中的能量变化、焓变的意义、热化学方程式的书写,特别是几种特殊的反应热比如燃烧热的热化学方程式的书写。
本题难度:一般
2、选择题 已知反应:下列结论正确的是
[? ]
①101KPa时,2C(s)+O2(g)=2CO(g);ΔH=-221kJ/mol
②稀溶液中,H+(aq)+OH-(aq)=H2O(l);ΔH=-57.3kJ/mol
A.碳的燃烧热大于110.5kJ/mol
B.①的反应热为221kJ/mol
C.稀硫酸与稀NaOH溶液反应的中和热为-57.3kJ/mol
D.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量
参考答案:A
本题解析:
本题难度:简单
3、选择题 下列液体均处于25℃,有关叙述中,正确的是
A.某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍
C.浓度相同的氨水与盐酸等体积混合,所得溶液pH=7
D.pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-)
参考答案:D
本题解析:溶液中水电离出的c(H+)=10-13,则该溶液中水的电离是被抑制的,所以溶液可能显酸性,也可能显碱性,A不正确;pH=4.5和pH=6.5的溶液中c(H+)分别是10-4.5和10-6.5,所以二者的氢离子浓度之比是100︰1,B不正确;一水合氨是弱电解质,和盐酸恰好反应时,生成的氯化铵水解,溶液显酸性,C不正确;选项D中根据电荷守恒可知c(H+)+c(Na+)=c(CH3COO-)+c(OH-),如果pH=7,则c(H+)=cc(OH-),所以c(Na+)=c(CH3COO-),D正确,答案选D。
本题难度:简单
4、选择题 下列溶液,按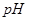 由小到大顺序排列的是
由小到大顺序排列的是
①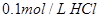 溶液?②
溶液?②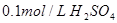 溶液
溶液
③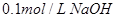 溶液?④
溶液?④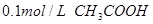 溶液
溶液
A.①②④③
B.②①④③
C.③④①②
D.④③②①
参考答案:B
本题解析:氢离子浓度越大,首先越强,而pH越小。硫酸是二元强酸,盐酸是一元强酸,产生是一元弱酸,氢氧化钠是一元强碱,所以pH由小到大的顺序是②①④③,答案选B。
本题难度:简单
5、选择题 某兴趣小组经实验测定,在1×105 Pa,298 K条件下,1 mol氢气完全燃烧生成水蒸气放出242 kJ热量,下列热化学方程式正确的是? ( )
A.H2O(g)=H2(g)+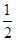 O2(g) ΔH=+242 kJ·mol-1
O2(g) ΔH=+242 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+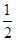 O2(g)=H2O(g) ΔH=+242 kJ·mol-1
O2(g)=H2O(g) ΔH=+242 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484 kJ·mol-1
参考答案:A
本题解析:1 mol H2完全燃烧生成水蒸气时放出的热量为242 kJ,故C、D选项中热量值应为负值,不正确;B选项H2O的状态应为气态,不正确;H2O的分解反应与化合反应方向相反,吸热与放热的数值相等。
本题难度:一般