时间:2020-08-23 06:22:48
1、选择题 在一定温度时,N2与H2反应过程中能量变化的曲线如图.下列叙述正确的是( ? )
A.该反应的热化学方程式为:N2+3H2?2NH3△H=-92kJ/moL
B.b曲线是加入催化剂时的能量变化曲线
C.加入催化剂,该化学反应的放热增多
D.加入催化剂可增大正反应速率,降低逆反应速率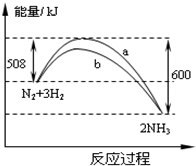
2、填空题 (9分)(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) 2NH3(g) +
2NH3(g) + 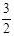 O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92.4kJ·mol—1
2NH3(g) ΔH= -92.4kJ·mol—1 2H2O(l) ΔH = -571.6kJ·mol—1
2H2O(l) ΔH = -571.6kJ·mol—13、填空题 反应热是指反应过程中放出或吸收的热量。由于在化学反应过程中发生物质变化时,同时伴有能量变化,根据反应的情况不同,一般将反应热分为燃烧热和中和热等多种形式。
(1)许多化学反应的反应热可以直接测量,其测量的仪器叫做__________________。
(2)下列ΔH表示物质燃烧热的是________;表示物质中和热的是________________。
A.?2H2(g)+O2(g)===H2O(l)?ΔH1
B.?C(s)+1/2O2(g)===CO(g)?ΔH2
C.?CH4(g)+2O2(g)===CO2(g)+2H2O(g)?ΔH3
D.?C(s)+O2(g)===CO2(g)?ΔH4
E.?C6H12O6(s)+6O2(g)===6CO2(g)+6H2O(l)?ΔH5
F.?NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)?ΔH6
G.?2NaOH(aq)+H2SO4(aq)===Na2SO4(aq)+2H2O(l)?ΔH7
H.?CH3COOH(aq)+NaOH(aq)===CH3COONa(aq)+H2O(l)?ΔH8
(3)甲硅烷(SiH4)是一种无色液体,遇到空气能发生爆炸性自燃,生成(SiO2)和水。已知室温下10?g甲硅烷自燃放出热量446?kJ,表示其燃烧热的热化学方程式为_________________________________________。
(4)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2是放热反应,当1?mol?Cl2参与反应时释放145?kJ的热量,写出这个反应的热化学方程式:?___________________________。
(5)充分燃烧一定量的丁烷放出的热量为Q?kJ,经测定完全吸收生成的二氧化碳需消耗5?mol/L的KOH溶液100?mL,恰好生成正盐。燃烧1?mol丁烷放出的热量是______________。
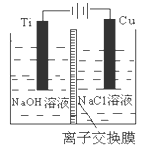
4、填空题 (14分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法:2Cu+H2O 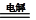 Cu2O+H2↑ Cu2O+H2↑ |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
 2H2(g)+O2(g)
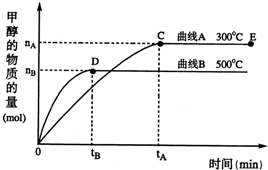
2H2(g)+O2(g) 5、简答题 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):
CO(g)+2H2(g)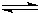
CH3OH(g)
根据题意完成下列各题:反应达到平衡时,
(1)平衡常数表达式K=______,升高温度,K值______(填“增大”、“减小”或“不变”).
(2)在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=______(用?nB?tB?表示)
(3)在其他条件不变的情况下,对处于E点的体系体积压缩到原来的
| 1 2 |
| n(H2) n(CH3OH) |