时间:2020-08-23 06:22:28
1、选择题 X、Y两元素的原子,当它们分别获得1个电子后,都形成稀有气体的电子层结构,X放出的能量大于Y,那么下列推断中不正确的是( )
A.原子序数X>Y
B.还原性X-<Y-
C.氧化性X>Y
D.酸性HX<HY
参考答案:非金属元素的原子获得相同数目的电子放出热量越多,生成的阴离子越稳定,原子的非金属性越强,
由此可知:X的非金属性比Y的强,氧化性X>Y,其还原性Y->X-,原子序数Y>X.气态氢化物的水溶液酸性HY>HX.
故选A.
本题解析:
本题难度:一般
2、选择题 A元素的原子最外层(M层)有2个电子,B元素原子最外层(L层)有6个电子,则A和B形成的化合物的式量为?
[? ]
A.56?
B.88?
C.74?
D.40
参考答案:D
本题解析:
本题难度:简单
3、填空题 某元素原子的核电荷数是电子层数的5倍,其质子数是最外层电子数的3倍,该元素的原子结构示意图是
________________。
参考答案: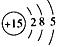
本题解析:
本题难度:一般
4、选择题 已知短周期元素的离子?A2+,B+,C3-,D-?都具有相同的电子层结构,则下列叙述正确的是( )
A.单质的还原性A>B>D>C
B.原子序数D>C>B>A
C.原子半径A>B>D>C
D.离子半径C>D>B>A
参考答案:短周期元素的离子:A2+,B+,C3-,D-都具有相同的电子层结构,所以A、B在周期表中C、D的下一周期,原子序数:A>B>D>C.
A、A、B在周期表中同周期,原子序数:A>B,金属性:B>A,对应单质的还原性:B>A,C、D为非金属,单质主要表现氧化性,故A错误;
B、A2+,B+,C3-,D-都具有相同的电子层结构,所以A、B在周期表中C、D的下一周期,原子序数:A>B>D>C
,故B错误;
C、A、B在周期表中C、D的下一周期,原子序数:A>B>D>C,原子核外电子层数越多,半径越大,同周期元素原子序数越大,半径越小,则有原子半径:B>A>C>D,故C错误;
D、A2+,B+,C3-,D-都具有相同的电子层结构,核电荷数越大,离子半径越小,核电荷数A>B>D>C,所以离子半径C>D>B>A,故D正确.
故选:D.
本题解析:
本题难度:一般
5、填空题 A、B、C、D是短周期的四种元素,其原子序数依次增大.已知A、D同主族,C、D同周期,A原子L层电子数是K层电子数的2倍,B原子最外层有6个电子,且A原子和D原子的最外层电子数之和等于B原子和C原子的最外层电子之和.请用化学用语回答以下问题:
(1)A、B、C、D原子半径由小到大的顺序______.
(2)写出由上述元素组成的单质和化合物之间相互作用发生置换反应的一个化学方程式:______
(3)B和C两元素组成的化合物在固态时属于______晶体(填晶体类型),其电子式为______
(4)在101kPa时,1.4gAB气体完全燃烧,生成2.2gAB2气体时放出14.15KJ?热量,表示AB燃烧热的热化学方程式为:______.
参考答案:A、B、C、D是短周期的四种元素,其原子序数依次增大.A原子L层电子数是K层电子数的2倍,L层电子数为4,即A为C;已知A、D同主族,则D为Si;C、D同周期,且A原子和D原子的最外层数之和等于B原子和C原子的最外层电子之和,设C的最外层电子数为x,则4+4=x+6,x=2,C为第三周期,则C为Mg,所以B为第二周期,B原子最外层有6个电子,即B为O,(1)电子层越多,半径越大,同周期原子半径从左向右减小,则原子半径为O<C<Si<Mg,故答案为:O<C<Si<Mg;
(2)碳与二氧化硅能发生置换反应,反应为C+SiO2?高温?.?Si+2CO↑,镁与二氧化碳能发生置换反应,反应为
2Mg+CO2?点燃?.?2MgO+C,
故答案为:C+SiO2?高温?.?Si+2CO↑(或2Mg+CO2?点燃?.?2MgO+C);
(3)MgO为离子构成的,则属于离子晶体,其电子式为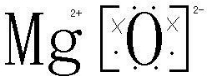
,
故答案为:离子;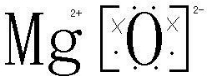
;
(4)1.4gCO气体完全燃烧,生成2.2gCO2气体时放出14.15kJ热量,则1molCO燃烧放出的热量为281.4×14.15kJ=283kJ/mol,
则热化学反应方程式为CO(g)+12O2(g)═CO2(g)△H=-283kJ/mol,故答案为:CO(g)+12O2(g)═CO2(g)△H=-283kJ/mol.
本题解析:
本题难度:简单