时间:2020-08-23 06:18:54
1、计算题 工业上用丁烷氧化法制醋酸,反应的化学方程式可表示为:
2C4H10+5O2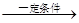 4CH3COOH+2H2O
4CH3COOH+2H2O
现用58吨丁烷为原料制取醋酸,求:
(1)理论上需要标准状况下的空气?m3(设空气中O2、N2的体积分数分别为0.2、0.8),同时生成水?吨。
(2)若生成的醋酸溶解在生成的水中,所得醋酸的质量分数为?%。
(3)若同时生产质量分数为100%的冰醋酸m1吨和质量分数为50%的醋酸m2吨,且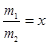 ,需补充水y吨,则y与x的关系式为?(用含x的代数式表示y);若不补充水,则m1+m2=?。
,需补充水y吨,则y与x的关系式为?(用含x的代数式表示y);若不补充水,则m1+m2=?。
参考答案:(5分)(1)2.8×105 ;18(2)86.96%(3)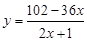 ?;138;每空1分
?;138;每空1分
本题解析:(1)令O2需要的物质的量为xmol
则2C4H10+5O2=4CH3COOH+2H2O
58×2g?5mol
58×106?xmol
解得x=2.5×106mol
所以需要空气的体积为(2.5×106
令生成水y吨,则:
2C4H10+5O2=4CH3COOH+2H2O
58×2g?18×2g
58吨?y吨
所以y=18吨
(2)令生成醋酸m吨,则
2C4H10+5O2=4CH3COOH+2H2O
58×2g?4×60g
58吨?m吨
所以m=120吨
由(1)中计算可知,生成水18吨,生成的醋酸溶解在生成的水中,所得醋酸的质量分数为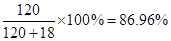
(3)由题意可知,m1+50%×m2=120
若需补充水y吨,则50%×m2=8+y
所以m2=36+2y
则m1=120-18-y=102-y
即102-y=x(36+2y)
即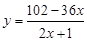
若不补充水,50%×m2=18
所以m2=36
故m1=120-50%×m2=102
所以m1+m2=36+102=138
故y=138
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,旨在培养学生分析、归纳和总结问题的能力,有利于调动学生的学习兴趣,激发学生的学习积极性。也有助于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般
2、计算题 将3.25g锌投入200mL某浓度的盐酸中,锌和盐酸恰好完全反应。
求:(1)反应中生成的H2在标准状况下的体积;
(2)所用盐酸中HCl的物质的量浓度。
参考答案:1.12L;0.5mol/L
本题解析:n(Zn)=3.25g÷65g/mol=0.05mol,则根据反应式可知
Zn? +? 2HCl ="=" ZnCl2 ?+? H2↑
1 mol? 2 mol? 1 mol
0.05mol? 0.1mol? 0.05mol
所以V(H2)=0.05mol ×22.4L/mol ="=" 1.12L
c(HCl)= 0.1mol÷0.2L=0.5mol /L
本题难度:一般
3、选择题 有不纯的CuCl2,质量为13.5 g,与适量AgNO3溶液反应,可生成29.g沉淀,则该氯化铜中所含的杂质是下列中的()
A.KCl
B.CaCl2
C.BaCl2
D.NaCl
参考答案:BD
本题解析:本题如果按常规思路解题,非常烦琐,甚至无从下手。但如果把AgCl沉淀的质量折算成氯元素的质量,根据“元素守恒”和“中间值法”巧解,则较为方便。
方法一:29 g AgCl沉淀中含氯元素的质量为:
29 g×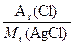 ="29" g×
="29" g×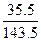 ="7.17" g
="7.17" g
13.5 g纯CuCl2中含氯元素的质量为:
13.5 g×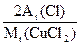 ="13.5" g×
="13.5" g×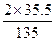 ="7.1" g
="7.1" g
因7.1 g<7.17 g,所以杂质中氯的质量分数>CuCl2中氯的质量分数。
通过比较,可知只有B、D选项符合题意。
方法二:极端假设法。
若13.5 g为纯CuCl2,则n(CuCl2)="0.1" mol,生成n(AgCl)="0.2" mol,AgCl沉淀质量为28.7 g,小于现有沉淀29 g,说明混入的杂质Cl-的含量应大于CuCl2中Cl-的含量。将选项中化学式变形:
A.2KCl? B.CaCl2?C.BaCl2?D.2NaCl
观察比较得知金属的相对原子质量小于CuCl2中Cu(64)的CaCl2和NaCl满足题意。
本题难度:简单
4、填空题 某同学配制一定物质的量浓度的NaOH溶液时,如果出现下列情况,会使溶液的物质的量浓度如何变化?
(1)所用NaOH固体已潮解,则结果______(填“偏高”“偏低”或“不变”下同)
(2)向容量瓶中加蒸馏水时超过了刻度线后,又用滴管把多出的部分吸走,则结果______
(3)小烧杯,玻璃棒未洗净,则结果______
(4)观察刻度线时仰视,则结果______
(5)所用容量瓶中已有少量蒸馏水,则结果______.
参考答案:(1)所用NaOH固体已潮解,实际称量的氢氧化钠的质量偏小,所配溶液的体积偏低,故答案为:偏低;
(2)向容量瓶中加蒸馏水时超过了刻度线,导致所配溶液的体积偏低,溶液的浓度判断,溶液是均匀的,配制完全再用滴管把多出的部分吸走,剩余溶液的浓度与原配制溶液的浓度相同,故溶液浓度偏低,故答案为:偏低;
(3)小烧杯,玻璃棒未洗净,少量氢氧化钠沾在烧杯壁、玻璃棒上,移入容量瓶内氢氧化钠的物质的量减小,所配溶液的浓度偏低,故答案为:偏低;
(4)观察刻度线时仰视,导致所配溶液的体积偏大,使所配溶液的浓度偏低,故答案为:偏低;
(5)溶液配制需加水定容.所用容量瓶中已有少量蒸馏水,对所配溶液的浓度无影响,所配溶液的浓度不变,答案为:不变.
本题解析:
本题难度:一般
5、选择题 有关气体体积的以下说法中错误的是(?)
A.气体的体积主要决定于气体分子间的距离
B.非标准状况下气体摩尔体积也可能等于22.4 L/mol
C.升高温度能增大气体分子间的距离从而使气体体积增大
D.物质的量相等的气体的体积比固体或液体的体积大得多
参考答案:A
本题解析:略
本题难度:简单