时间:2020-08-23 06:18:54
1、填空题 ①在进行过滤操作时,需用到的玻璃仪器是____________
②在进行分液和配制物质的量浓度溶液时,首先要分别对分液漏斗、容量瓶进行_______
③用一种试剂除去NaCl溶液中含有的CuCl2,写出所用试剂及反应的离子方程式除杂试剂: (写化学式) 离子方程式:____________、_____________________
参考答案:①烧杯、漏斗、玻璃棒
②查漏
③除杂试剂:NaOH;离子方程式:Cu2++2OH-==Cu(OH)2↓
本题解析:
本题难度:一般
2、选择题 与3.2gSO2所含的氧原子数相等的NO2的质量为( )
A.3.2g
B.4.6g
C.6.4g
D.2.3g
参考答案:D
本题解析:
本题难度:简单
3、计算题 由锌和铜构成的合金共10 g,放入足量的稀盐酸中充分反应,产生标准状况下气体2.24L,试求合金中铜的质量分数。
参考答案:35%
本题解析:设合金中含Zn质量为x g
Zn? +? 2HCl? =? ZnCl2? +? H2↑?
65 g?22.4 L
x g? 2.24 L
解得x =" 6.5" g
则Cu的质量分数为(10 — 6.5)/10 = 35%…
点评:该题是高考中的常见题型,属于基础性试题的考查。试题基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的训练,有利于提高学生的逻辑推理能力和规范答题能力。该题的关键是明确反应的原理,然后结合方程式灵活运用即可。
本题难度:一般
4、填空题 (1)8 g CH4的物质的量为?,在标准状况下所占的体积约为?;
(2)100mL 1 mol·L-1Al2(SO4)3溶液中含Al3+离子?mol,含SO42-离子?个。
(3)0.6mol O2与0.4mol O3质量之比为?,分子个数之比为?,原子个数之比?,它们在同温同压下的体积比是?。
参考答案:(每空2分,共8分)(1)0.5mol;11.2L (2)0.2;1.806X1023个 (3)1:1;3:2;1:1;3:2
本题解析:(1)甲烷的摩尔质量是16g/mol,则根据n=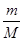 可知,8 g CH4的物质的量=8g÷16g/mol=0.5mol;标准状况下气体的摩尔体积是22.4L/mol,则根据n=
可知,8 g CH4的物质的量=8g÷16g/mol=0.5mol;标准状况下气体的摩尔体积是22.4L/mol,则根据n=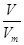 可知,在标准状况下所占的体积约为0.5mol×22.4L/mol=11.2L。
可知,在标准状况下所占的体积约为0.5mol×22.4L/mol=11.2L。
(2)100mL 1 mol·L-1Al2(SO4)3溶液中硫酸铝的物质的量=0.1L×1mol/L=0.1mol,则根据Al2(SO4)3=2Al3++3SO42-可知,溶液中含Al3+离子的物质的量=0.1mol×2=0.2mol。溶液中含SO42-离子的物质的量=0.1mol×3=0.3mol,则个数=0.3mol×6.02X1023/mol=1.806X1023个。
(3)氧气和臭氧的相对分子质量分别是32和48,则根据n=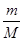 可知,0.6mol O2与0.4mol O3质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1;根据N=nNA可知,分子个数之比为0.6mol:0.4mol=3:2;原子个数之比=0.6mol×2:0.4mol×3=1:1;根据n=
可知,0.6mol O2与0.4mol O3质量之比为0.6mol×32g/mol:0.4mol×48g/mol=1:1;根据N=nNA可知,分子个数之比为0.6mol:0.4mol=3:2;原子个数之比=0.6mol×2:0.4mol×3=1:1;根据n=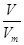 可知,它们在同温同压下的体积比=0.6mol:0.4mol=3:2。
可知,它们在同温同压下的体积比=0.6mol:0.4mol=3:2。
本题难度:一般
5、选择题 NaCl溶液的物质的量浓度的含义是
A.每升水含NaCl的质量
B.每升溶液含NaCl的质量
C.每升水含NaCl的物质的量
D.每升溶液含NaCl的物质的量
参考答案:D
本题解析:NaCl溶液的物质的量浓度为每升溶液含NaCl的物质的量,选D。
考点:考查物质的量浓度的含义。
本题难度:一般