时间:2020-08-13 07:28:00
1、选择题 控制适合的条件,将反应2Fe3++2I- 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
参考答案:D
本题解析:由图示结合原电池原理分析可知,Fe3+得电子变成Fe2+被还原,I-失去电子变成I2被氧化,所以A、B正确;电流计读数为零时Fe3+得电子速率等于Fe2+失电子速率,反应达到平衡状态;D项在甲中溶入FeCl2固体,平衡2Fe3++2I- 2Fe2++I2向左移动,I2被还原为I-,乙中石墨为正极,D不正确。
2Fe2++I2向左移动,I2被还原为I-,乙中石墨为正极,D不正确。
本题难度:一般
2、选择题 将纯锌片和纯铜片按下图所示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是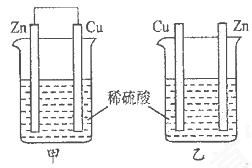
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的酸性均减弱
D.产生气泡的速率甲比乙慢
参考答案:C
本题解析:A、甲烧杯可以形成原电池,Cu作正极,有气泡产生,错误;B、乙不是闭合回路,不能形成原电池,不存在正负极,错误;C、2个装置中的反应的实质都是Zn与氢离子反应生成氢气,所以酸性均减弱,正确;D、甲发生的是电化学反应,乙发生的是化学反应,电化学反应速率比化学反应速率快,错误,答案选C。
本题难度:一般
3、填空题 (10分)(1)在右图的银锌原电池中,银为?极,电极上发生的是?反应(“氧化”或“还原”),电极反应式是?。锌片上观察到的现象为?,电极反应式为?。
(2)若反应过程中有0.2mol电子发生转移,则生成的铜为?g 。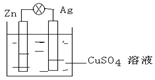
参考答案:(1)正?还原?Cu 2++2e-==Cu?锌片溶解?Zn—2e-==Zn2+
(2) 6.4 g
本题解析:略
本题难度:简单
4、选择题 某课外活动小组使用下列用品设计原电池。用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)500mL,、烧杯。下列说法正确的是
A.该装置能将电能转化为化学能? B.实验过程中铜片逐渐溶解
C电子由铁片通过导线流向铜片? D.铁片上会析出红色的铜
参考答案:C
本题解析:略
本题难度:简单
5、选择题 一学生欲通过实验判断X,Y,Z,W四块金属的活泼性,?做了如下实验并得结论:当X,Y组成原电池时,Y为负极;当Z,W组成原电池时,W为正极;W能将Y从其盐溶液中置换出来,据此可知它们的活泼性顺序是
A.Z>W> X > Y
B.Z>W> Y>X
C.X>Y>W>Z
D.X>Y>Z>W
参考答案:B
本题解析:原电池中较活泼的金属作负极,较不活泼的金属作正极。据此可判断,Y大于X,Z大于W。又因为金属性强能把金属性弱的金属阳离子从盐溶液中中置换出来,所以W的金属性强于Y的,因此金属性强弱顺序为Z>W>Y>X,即答案选B。
本题难度:简单