时间:2020-08-13 07:27:39
1、选择题 酸根RO3-所含电子数比硝酸根离子(NO3-)的电子数多10,下列说法中正确的是( )
A.R是第三周期元素
B.RO3-和NO3-均只能被还原,不能被氧化
C.R元素的最高正价与N元素最高正价相同
D.R和N两元素的单质都是空气的主要成分
2、选择题 X、Y、Z、R是短周期主族元素,X原子最外层电子数是次外层的两倍,Y元素在地壳中的含量最多,Z元素的化合物的焰色反应呈黄色,R原子的核外电子数是X原子与Z原子的核外电子数之和。下列叙述正确的是
A.X与Y能形成两种常见的气态化合物
B.原子半径的大小顺序: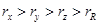
C.X、Z分别与R形成的化合物中化学键类型不同
D.含有Y、Z、R三种元素的化合物最多只有2种
3、选择题 下列物质中均为化合物的一组是
A.金刚石、干冰、SO2
B.KCl、盐酸、NaOH
C.CuSO4?5H2O、冰、乙醇
D.臭氧、CaCO3、铝合金
4、选择题 X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示.若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是
| X | Y | ? |
| ? | Z | W |
5、填空题 (11分,最后一空为2分,其余各1分)下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
| 主族? 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ? | ? | ? | ? | ① | ? | ② | ? |
| 三 | ③ | ④ | ⑤ | ⑥ | ? | ? | ⑦ | ⑧ |
| 四 | ⑨ | ? | ? | ? | ? | ? | ⑩ | ? |