时间:2020-08-13 07:22:27
1、简答题 把煤作为燃料可通过下列两种途径:
途径I:煤直接燃烧C(s)+O2?(g)═CO2(g)△H1<0?①
途径II:先制成水煤气:C(s)+H2O(g)═CO(g)+H2(g)△H2>0?②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0?③
2H2(g)+O2?(g)═2H2O(g)△H4<0?④
请回答下列问题:
(1)燃烧等量的煤,途径I放出的热量______(填“大于”“等于”或“小于”)途径II放出的热量,其理论依据是______;
(2)△H1、△H2、△H3、△H4的数学关系式是______.
参考答案:(1)根据盖斯定律可知,反应热只与始态和终态有关,而与反应的途径无关,通过观察可知途径Ⅰ和途径Ⅱ是等效的,途径Ⅰ和途径Ⅱ等量的煤燃烧消耗的氧气相等,两途径最终生成物只有二氧化碳,所以途径Ⅰ放出的热量等于途径Ⅱ放出的热量.
故答案为:等于;盖斯定律.
(2)途径Ⅱ:C(s)+H2O(g)═CO(g)+H2(g)△H2>0?②
再燃烧水煤气:2CO(g)+O2(g)═2CO2(g)△H3<0?③
2H2(g)+O2?(g)═2H2O(g)△H4<0?④
由盖斯定律可知,②×2+③+④得2C(s)+2O2?(g)═2CO2(g)△H=2△H2+△H3+△H4.
所以△H1=12△H=12(2△H2+△H3+△H4)=△H2+12(△H3+△H4).
故答案为:△H1=△H2+12(△H3+△H4).
本题解析:
本题难度:一般
2、选择题 在298K、100kPa时,已知: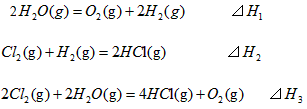
则⊿H1与⊿H2和⊿H3间的关系正确的是
[? ]
A.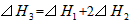
B.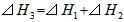
C.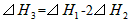
D.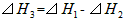
参考答案:A
本题解析:
本题难度:一般
3、选择题 已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,如图(Ⅰ)所示:△H1=△H2+△H3,根据上述原理和图(Ⅱ)所示,判断各对应的反应热关系中不正确的是( ? )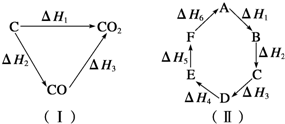
A.A→F△H=-△H6
B.A→D△H=△H1+△H2+△H3
C.△H1+△H2+△H3+△H4+△H5+△H6=0
D.△H1+△H6=△H2+△H3+△H4+△H5
参考答案:D
本题解析:
本题难度:一般
4、选择题 已知
(l) =H2O(g) △H1=a kJ·
=H2O(g) △H1=a kJ·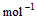
(2)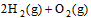 =2H2O(g) △H2=b kJ·
=2H2O(g) △H2=b kJ·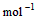
(3)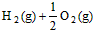 =H2O(l) △H3=c kJ·
=H2O(l) △H3=c kJ·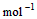
(4) =2H2O(l) △H4=d kJ·
=2H2O(l) △H4=d kJ· 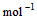
下列关系式中正确的是
[? ]
A.a<c <0
B.b>d>0
C.2a=b<0
D.2c=d>0
参考答案:C
本题解析:
本题难度:一般
5、简答题 (1)已知下列反应:
2CO(g)+SO2(g)═S(g)+2CO2(g)△H=+8.0kJ?mol-1 ①
2H2(g)+SO2(g)═S(g)+2H2O(g)△H=+90.4kJ?mol-1②
2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ?mol-1③
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ?mol-1④
则S(g)与O2(g)反应生成SO2(g)的热化学方程式可表示为______
(2)NH4Cl溶液显______性,原因是(用离子方程式表示)______
(3)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=______;
(4)已知水存在如下平衡:H2O+H2O?H3O++OH-△H>0,现欲使平衡向右移动,且所得溶液显酸性,选择方法是______.
A.向水中加入NaHSO4固体B.向水中加Na2CO3固体
C.加热至100℃[其中c(H+)=1×10-6mol?L-1]
D.向水中加入(NH4)2SO4固体
(5)若等浓度、等体积的NaOH溶液和NH3?H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH相等,则m______n(填“<”、“>”或“=”).
参考答案:(1)根据盖斯定律,④+③-①-②可得:2S(g)+2O2(g)=2SO2(g)△H=-1147.64kJ?mol-1,即S(g)+O2(g)=SO2(g)△H=-573.8kJ?mol-1,
故答案为:S(g)+O2(g)=SO2(g)△H=-573.8kJ?mol-1;
(2)氯化铵是强酸弱碱盐,能水解导致溶液中氢离子浓度大于氢氧根离子浓度,水解离子方程式为:NH4++H2O?NH3?H2O+H+,溶液呈酸性,
故答案为:酸性;NH4++H2O?NH3?H2O+H+;
(3)常温下,pH=11的CH3COONa溶液中氢氧根离子浓度为:c(OH-)=0.001mol/L,醋酸根离子结合水电离的氢离子,促进了水的电离,醋酸钠溶液中的氢氧根离子就是水电离的,所以c水电离出来的c(OH-)=0.001mol/L,
故答案为:0.001mol/L;
(4)A.向水中加入NaHSO4固体,电离出的氢离子抑制水的电离,故A错误;
B.向水中加Na2CO3固体,水解呈碱性,故B错误;
C.加热至100℃,促进水的电离,溶液呈中性,故C错误;
D.向水中加入(NH4)2SO4固体,水解呈酸性,故D正确;
故答案为:D;
(5)氨水为弱电解质,不能完全电离;等浓度、等体积的NaOH溶液和NH3?H2O溶液,氢氧化钠溶液中氢氧根离子浓度大,若稀释后溶液的pH相等,氢氧化钠溶液稀释的体积一定大于氨水氨水溶液体积,
故答案为:>.
本题解析:
本题难度:简单