时间:2020-08-13 07:19:38
1、填空题 (10分)短周期A、B、C、D 4种元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D与B属于同一族元素。
(1)元素:A为________,D的质子数和中子数相等,D的原子组成符号为:_________,
它的最高价氧化物对应的水化物为:________。
(2)用电子式表示A、B两元素形成AB2的过程_____________________________
用电子式表示C、D两元素形成化学键的过程_______________________________
参考答案:(1)C 3216S H2SO4
(2)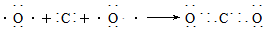
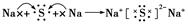
本题解析:两元素的单质反应,生成一种淡黄色的固体E,所以E是过氧化钠,则B是氧元素,C是钠元素。D与B属于同一族元素,因此D是S元素。又因为A的原子序数最小,且A原子的最外层上有4个电子,所以A是碳元素。
(1)A为C,D的质子数和中子数相等,所以D的原子组成符号为S。S元素的最高价是+6价,所以其最高价氧化物的水化物的化学式是H2SO4。
(1)CO2是含有极性键的共价化合物,所以用电子式表示其形成过程是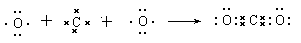 。硫化钠是含有离子间的离子化合物,其形成过程表示位
。硫化钠是含有离子间的离子化合物,其形成过程表示位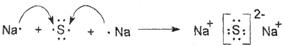 。
。
点评:本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。
本题难度:一般
2、实验题 某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读 数为V1
数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是?→ ??→ ?→D→??(均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________。
(4)D步骤中液面应调节到________________________________________________________________________,尖嘴部分应_____________________________________________________________。
(5)滴定终点时锥形瓶内溶液的pH约为____________,终点时颜色变化是
________________________________________________________________________。
(6)若酸式滴定管不用标准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响??(填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为_________ ______________________________________。
______________________________________。
参考答案:
本题解析:略
本题难度:简单
3、填空题 下表为元素周期表短周期的一部分
| ? | ? | ? | ? | ? |
| A | B | D | ? | ? |
| H | ? | ? | ? | ? |
参考答案:(1) SiO32— + CO2 + H2O ="===" H2SiO3 + CO32—? 1分
(2)2C+SiO2="2CO+Si?" 1分
(3)Al(OH)3 + OH— ="===" AlO2— + 2H2O?2分
(4)Al2O3+3C+3Cl2 2AlCl3+3CO (未注明条件扣1分)? ……2分
2AlCl3+3CO (未注明条件扣1分)? ……2分
(5)3NaN3==Na3N+4N2?2分
本题解析:略
本题难度:一般
4、填空题 A、B、C、D、E五种短周期元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:A?;B?;C ??。
(2)画出D的原子结构示意图_____;B在周期表的位置为第?周期?族。
(3)化合物A2D的电子式是_______________。
(4)B、C、D的气态氢化物稳定性由强到弱的顺序是_____________。(用化学式表示)
(5)B的最高价氧化物的结构式?。
(6)写出单质E与A2D反应的离子方程式??。
参考答案:(1)A? H ?;B? C?;C? N?(2)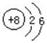 ?;第二周期第ⅣA族。
?;第二周期第ⅣA族。
(3)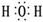 ?(4)H2O>NH3>CH4(5)O=C=O?(6)2Na+2H2O=2Na++2OH-+H2↑
?(4)H2O>NH3>CH4(5)O=C=O?(6)2Na+2H2O=2Na++2OH-+H2↑
本题解析:A是元素周期表中原子半径最小的元素,则A是氢元素。B元素原子L层上的电子数为K层电子数的2倍,所以B是碳元素。元素D的2价阴离子的核外电子排布与氖原子相同,则D是氧元素;C的原子序数介于BD之间,所以C是氮元素。E与A同主族,A和E这两种元素与D都能形成X2Y、X2Y2型化合物,且E的原子序数大于氧元素的,则E是钠元素。非金属性越强,氢化物的稳定性越强,则B、C、D的气态氢化物稳定性由强到弱的顺序是H2O>NH3>CH4。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力
本题难度:一般
5、填空题 (13分)下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
| ?主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ? | ? | ? | ① | ② | ③ | ? | ? |
| 3 | ④ | ? | ⑤ | ? | ? | ⑥ | ⑦ | ⑧ |
参考答案:(1)硫,3,ⅥA,。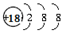 (2)HCl>H2S。(3)ONC。
(2)HCl>H2S。(3)ONC。
(4)HClO4;NaOH,离子。(5)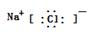 ,黄。(6)放热
,黄。(6)放热
本题解析:本题主要考查了元素周期律,同周期元素依序数的递增非金属性增强,金属性减弱;同主族元素,随序数的递增,金属性增强,非金属性减弱。
本题难度:一般