时间:2020-08-13 07:19:38
1、选择题 元素性质呈周期性变化决定因素是
A.元素半径大小呈周期性变化
B.元素相对质量依次递增
C.元素核外电子排布呈周期性变化
D.元素最高正化合价呈周期性变化
参考答案:C
本题解析:结构决定性质,即原子的核外电子排布尤其是最外层电子排布决定了元素的性质,所以
元素性质呈周期性变化的决定因素是元素原子核外电子排布呈周期性变化的必然结果,C正确。
本题难度:一般
2、选择题 下列说法错误的是?
A.在化合物 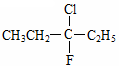 中,存在手性碳原子
中,存在手性碳原子
B.原子间形成分子时,决定各原子相互结合的数量关系的是共价键的饱和性?
C.根据对角线规则判断Be(OH)2是两性氢氧化物
D.在相同条件下,邻羟基苯甲醛的沸点高于对羟基苯甲醛
参考答案:AD
本题解析:A 错误,不存在手性碳原子
B 正确。
C 正确,Be和Al是对角线,氢氧化铝是两性氢氧化物,所以,Be(OH)2也是两性氢氧化物
D 错误,邻羟基苯甲醛的沸点低于对羟基苯甲醛
本题难度:简单
3、推断题 A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。它们之间的关系如下:
Ⅰ.原子半径:A < C < B < E< D?
Ⅱ.原子的最外层电子数:A = D? C= E? A + B = C
Ⅲ.原子的核外电子层数:B =" C" = 2A?
Ⅳ.B元素的主要化合价:最高正价 + 最低负价 = 2
请回答:
(1)甲为由A、B两种元素组成的常见气体,写出其电子式?;
(2)写出某黑色含F的磁性氧化物与E最高价氧化物对应水化物的稀溶液反应的离子方程式:?。装置1经过一段时间向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为?。单质F发生?(填电化学腐蚀类型)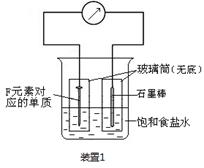
(3)向A、B、C三种元素组成的某盐稀溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为?,已知该盐溶液常温下呈酸性,则0.1mol/L该盐溶液中离子浓度的大小顺序为?。
(4)上述元素中的五种元素可形成一种常见复盐,经检测该复盐中三种离子的个数比为2:1:2。则该复
盐的化学式为?。为检验该复盐中的某种有色离子存在,请写出实验的操作步骤和现象?
?。
参考答案:(共14分)(1)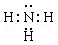 (1分)
(1分)
(2) Fe3O4+8H+=2Fe3++ Fe2++4H2O (2分);O2+2H2O+4e-=4OH- (2分) 吸氧腐蚀(1分)
(3) NH4NO2 + AgNO3=AgNO2↓+NH4NO3;c(NO2->c(NH4+)>c(H+)>c(OH-)(各2分)
(4)(NH4)2Fe(SO4)2、取少量该复盐于试管中并加水溶解,滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色,证明有Fe2+(或加氢氧化钠溶液,出现白色沉淀迅速变成灰绿色,最终变成红褐色。其他方案合理均可。)(各2分)
本题解析:A、B、C、D、E、F六种元素,其中A、B、C、D、E为短周期主族元素。根据原子的核外电子层数:B=C=2A可知,A为H元素,B、C为第二周期元素。原子的最外层电子数A=D,则D为Na元素。根据B元素的主要化合价:最高正价+最低负价=2可知。B为N元素。根据原子的最外层电子数:A+B=C可知,C为O元素。原子的最外层电子数:C=E可知,E为S元素。根据题中“某黑色含F的磁性氧化物”可知,F为Fe元素。
(1)A为H元素,B为N元素,甲为由A、B两种元素组成的常见气体,应为NH3。氨气是含有极性键的共价化合物,其电子式为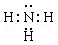 。
。
(2)黑色含F的磁性氧化物是四氧化三铁,其中Fe元素的化合价有+2价和+3价两种。E最高价氧化物对应水化物是硝酸,具有强氧化性,其稀溶液与四氧化三铁反应的离子方程式是Fe3O4+8H+=2Fe3++ Fe2++4H2O;根据装置1的构成可知,该装置是原电池,其中铁是负极,碳棒是正极。由于溶液是食盐水,所以发生的是钢铁的吸氧腐蚀,其中正极是氧气得到电子,其电极反应式是O2+2H2O+4e-=4OH-。
(3)A、B、C三种元素组成的盐为NH4NO2或NH4NO3,滴加AgNO3溶液生成白色沉淀,应为AgNO2沉淀,因为AgNO3溶于水,所以反应的化学方程式是NH4NO2 + AgNO3=AgNO2↓+NH4NO3;NH4NO2为强酸弱碱盐,水解呈酸性,所以溶液中离子浓度大小顺序为c(NO2->c(NH4+)>c(H+)>c(OH-)。
(4)复盐中三种离子的个数比为2:1:2,常见为(NH4)2Fe(SO4)2。其中有色离子是亚铁离子,亚铁离子具有还原性,其检验方法是取少量该复盐于试管中并加水溶解,滴加KSCN溶液,无明显现象,再滴加新制氯水,溶液立即变红色,证明有Fe2+(或加氢氧化钠溶液,出现白色沉淀迅速变成灰绿色,最终变成红褐色。或者滴加铁氰化钾溶液【K3[Fe(CN)6]】,立即有铁氰化亚铁的蓝色沉淀出现,反应式为:2Fe(CN)63-+Fe2+=Fe3[Fe(CN)6]2↓,证明有Fe2+。
本题难度:困难
4、填空题 (10分)有A、B、C、D、E五种短周期元素,它们的核电荷数按C、A、B、D、E
的顺序增大。C、D都能分别与A按原子个数比为1∶1或2∶1形成化合物;CB可与EA2
反应生成C2A和气态物质EB4;E的M层电子数是K层电子数的2倍。
(1)写出下列元素的名称:A_______,B_______, E_______。
(2)画出E的原子结构示意图_____?__。
写出电子式D2A2___?____,EB4__?_?____。
(3)比较EA2与EB4的熔点高低(填化学式)_______>_______。
(4)A的氢化物的沸点与同族下一周期元素的氢化物相比,A的氢化物的沸点?(填“高”或“低”),原因是?。
参考答案:(1)氧、氟、硅(2)略(3)SiO2;SiF4(4)高,因为A的氢化物分子间可形成氢键,而另一种则无。(每空1分共10分)
本题解析:略
本题难度:简单
5、选择题 X、Y、Z、W均为短周期元素,它们在周期表中相对位置如图所示。若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是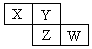
A.X的气态氢化物比Y的稳定
B.W的最高价氧化物对应水化物的酸性比Z的强
C.Z的非金属性比Y的强
D.X与Y形成的化合物都易溶于水
参考答案:B
本题解析:
分析:短周期元素,由图可知X、Y在第二周期,Y原子的最外层电子是内层电子数的3倍,则Y为氧元素,依次推出X为氮元素,Z为硫元素,W为氯元素,然后利用非金属性的强弱来分析解答.
解:短周期元素,由图可知X、Y在第二周期,Y原子的最外层电子是内层电子数的3倍,即K层电子为2,L层为6,其质子数为8,则Y为氧元素,由元素在周期表中的位置可知X为氮元素,Z为硫元素,W为氯元素,
A、同周期从左到右元素的非金属性增强,则非金属性Y>X,所以Y的气态氢化物比X的稳定,故A错误;
B、同周期从左到右元素的非金属性增强,则非金属性W>Z,所以W的最高价氧化物对应水化物的酸性比Z的强,故B正确;
C、同主族元素从上到下非金属性减弱,则非金属性Y>Z,故C错误;
D、X与Y形成的化合物NO不溶于水,故D错误;
故选B.
本题难度:一般