时间:2020-08-13 07:17:20
1、选择题 (7分) t℃时,某NaOH稀溶液中,c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,则:
(1)该温度下,水的离子积常数kw= 。
(2)在该温度下,将100mL0.1mol/L的稀硫酸与100mL0.4mol/L的NaOH溶液混合后,溶液的pH= 。
3)该温度下,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是 。
(4)该温度下,pH=2的某酸HA溶液和pH=10的NaOH溶液等体积混合后,混合溶液的pH=5。试分析其原因 。
参考答案:(1)10-12 (2)11 (3)a+b = 14
(4)HA为弱酸,使c(HA)>c(NaOH),反应后溶液呈酸性
本题解析:(1)稀溶液中氢离子和OH-的浓度之积是水的离子积,所以kw=c(H+)·c(OH-)=10-a·10-b=10-a-b=10-12。
(2)根据数据可判断氢氧化钠是过量的,所以反应后c(OH-)= 则c(H+)=
则c(H+)= ,所以pH=11。
,所以pH=11。
(3)混合后溶液呈中性,则氢离子的物质的量和OH-的物质的量相等,即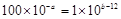 ,解得a+b=14。
,解得a+b=14。
(4)若HA是强酸,则二者恰好反应,溶液显中性。混合溶液的pH=5,说明溶液显酸性,因此HA一定是弱酸,即反应后HA是过量的,所以溶液才能显酸性。
本题难度:一般
2、填空题 按要求写出下列方程式:
(1)次氯酸的电离方程式______.
(2)氧化铝与氢氧化钠溶液反应的化学方程式______.
(3)二氧化锰与浓盐酸反应的离子方程式______.
参考答案:(1)次氯酸为弱酸,溶液中存在电离平衡,次氯酸的电离方程式为:HClO?H++ClO-,
故答案为:HClO?H++ClO-;
(2)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,反应的化学方程式为:Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(3)二氧化锰与浓盐酸在加热条件下反应生成氯气,反应的离子方程式为:MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl-△.Mn2++Cl2↑+2H2O.
本题解析:
本题难度:简单
3、选择题 下列溶液一定呈中性的是
A.c (H+) × c(OH-) =10-14的溶液
B.n(H+)=n(OH—) 的溶液
C.c (H+)=1.0×10-7 mol/L的溶液
D.pH=3的酸与pH=11的碱等体积混合后的溶液
参考答案:B
本题解析:溶液的酸碱性只与溶液中的c (H+) 和 c(OH-) 的相对大小有关。A中只知道c (H+) × c(OH-) =10-14,不能判断c (H+) 和 c(OH-) 的相对大小,无法确定酸碱性,错;n(H+)=n(OH—) 的溶液显中性,B对;没有指明温度,c (H+)=1.0×10-7 mol/L的溶液不能判断c (H+) 和 c(OH-) 的相对大小,无法确定酸碱性,C错;酸碱的强弱不知道,不能确定pH=3的酸与pH=11的碱等体积混合后溶液的酸碱性,D错。选B
考点:溶液的酸碱性的判断。
本题难度:一般
4、选择题 下列物质在水溶液中的电离方程式书写正确的是( )
A.H2CO3?2H++CO32-
B.NaHCO3═Na++H++CO32-
C.BaSO4═Ba2++SO42-
D.NH3?H2O═NH4++OH-
参考答案:C
本题解析:
本题难度:一般
5、选择题 下列溶液,按 由小到大顺序排列的是
由小到大顺序排列的是
① 溶液 ②
溶液 ② 溶液
溶液
③ 溶液 ④
溶液 ④ 溶液
溶液
A.①②④③
B.②①④③
C.③④①②
D.④③②①
参考答案:B
本题解析:酸中C(H+)越大,溶液的pH就越小。①是一元强酸,②是二元强酸,④是一元弱酸,③是一元强碱。当酸的浓度相等时,二元强酸的氢离子的浓度大于一元强酸的,一元强酸的大于一元弱酸的,碱中的氢离子浓度最小,因此C(H+)由大到小的顺序是②①④③ ,所以pH由小到大顺序排列②① ④ ③,选项是B。
考点:考查溶液中的pH 的大小排列顺序的知识。
本题难度:一般