时间:2020-08-13 07:15:38
1、填空题 燃煤废气中的氮氧化物(NOx)、二氧化碳等气体,常用下列方法处理,以实现节能减排、废物利用等。
(1)对燃煤废气进行脱硝处理时,常利用甲烷催化还原氮氧化物,如:
CH4(g) +4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H= -574 kJ/mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160 kJ/mol
则CH4(g)将NO2(g)还原为N2(g)等的热化学方程式为______________________。
将燃煤废气中的CO2转化为甲醚的反应原理为:2CO2(g)+6H2(g)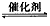 CH3OCH3(g)+3H2O(g) △H
CH3OCH3(g)+3H2O(g) △H
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表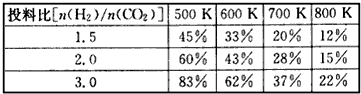
(2)若温度升高,则反应的平衡常数K将____(填“增大”“减小”或“不变”。下同);若温度不变,提高投料比[n(H2)/n(CO2)],则K将____。该反应的△H____0(填“>”“<”或“=”);
(3)若用甲醚作为燃料电池的原料,请写出在碱性介质中电池负极的电极反应式_________________
(4)利用甲醚燃料电池设计如图所示的装置,则该装置中Zn极为______极;B中Cu2+向______极(填Zn或Cu)移动。当Zn片的质量变化为6.4 g时,a极上消耗的O2在标准状况下的体积为______L。 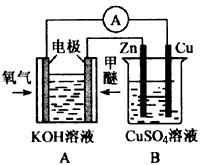
参考答案:(1)CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-867 kJ/mol
(2)减小;不变;<
(3)CH3OCH3-12e-+16OH-=2CO32-+11H2O
(4)阴;Zn; 1.12
本题解析:
本题难度:一般
2、简答题 下列装置或操作能达到实验目的是( )
A.除去乙醇中的乙酸
B.形成原电池
C.制取乙酸乙酯
D.石油的蒸馏
参考答案:A.乙醇与乙酸混溶,不能用分液的方法分离,故A错误;
B.酒精为非电解质,溶液不能导电,不能形成原电池,故B错误;
C.制取乙酸乙酯时,右边试管不能塞橡皮塞,防止压强过大而导致实验事故,故C错误;
D.石油蒸馏时,温度计水银球应在支管口附近,且从冷凝管的下端进水,上口出水,装置图符合,故D正确.
故选D.
本题解析:
本题难度:一般
3、填空题 如图装置中,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹,a、b为电源两极.在A、B中充满KOH溶液后使其倒立于盛有KOH溶液的水槽中.切断K1,闭合K2、K3,通直流电,电解一段时间后A、B中产生体积不相等的无色气体,如图所示. 
(1)试管B中收集的气体是?(填化学式)电源的a极为 (填“正极”或“负极”).
(2)写出铂夹C上发生的电极反应式:?
(3)写出A中电极反应式:?.
(4)若电解一段时间后A、B中均有气体包围电极.此时切断K2、K3,闭合K1,电流表的指针发生偏转,此时B极的电极反应式为? .
参考答案:(1)H2?负极?
(2)2H+ + 2e- = H2↑?
(3)4OH- - 4e- = O2↑+2H2O?
(4)H2+2OH- -2e- = 2H2O
本题解析:
①切断K1,合闭K2、K3通直流电,电极A、B及氢氧化钾溶液构成电解池,根据离子的放电顺序,溶液中氢离子、氢氧根离子放电,分别生成氢气和氧气,氢气和氧气的体积比为2:1,通过图象知,B极上气体体积是A极上气体体积的2倍,所以B极上得氢气,A极上得到氧气,所以B极是阴极,A极是阳极,故a是负极,b是正极.
故答案为:B极上得氢气,负;
⑵C极上氢离子得电子生成氢气,电极反应式为4H++4e=2H2↑.
故答案为: 4H++4e=2H2↑;
⑶A极上氢氧根离子失电子生成氧气和水,电极反应式为4OH--4e=2H2O+O2↑;
故答案为:4OH--4e=2H2O+O2↑;
⑷切断K2、K3,合闭K1,电解一段时间后,A、B中均有气体包围电极.此装置构成氢氧燃料原电池,所以有电流通过,电流表的指针移动.此时B极为负极,电极反应式为H2+2OH- -2e- = 2H2O
故答案为:H2+2OH- -2e- = 2H2O
本题难度:简单
4、选择题 根据下图,下列判断中正确的是( )
A.烧杯a中的溶液pH降低
B.烧杯b中发生氧化反应
C.烧杯a中发生的反应为2H++2e-===H2
D.烧杯b中发生的反应为2Cl--2e-===Cl2
参考答案:B
本题解析:由题给原电池装置可知,电子经过导线,由Zn电极流向Fe电极,则O2在Fe电极发生还原反应:O2+2H2O+4e-===4OH-,烧杯a中c(OH-)增大,溶液的pH升高。烧杯b中,Zn发生氧化反应:Zn-2e-===Zn2+。
本题难度:一般
5、填空题 (9分)下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是 ,N的电极电极反应式为: ;乙池的总反应式是 ,通入甲烷的铂电极上发生的电极反应式为 __________________________ 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为 。
参考答案:(9分)(1) 铁 , 4 OH- - 4 e- = O2 ↑ + 2H2O ,
4AgNO3+2H2O 4Ag+ O2↑+4HNO3, CH4-8e-+10OH-= CO32-+7H2O 。
4Ag+ O2↑+4HNO3, CH4-8e-+10OH-= CO32-+7H2O 。
(2) 0.224 L, 0.1mol/L (每空1分)
本题解析:(1)甲是燃料电池,通入甲烷的电极是负极,通入氧气的是正极。所以M是阴极,N是阳极。由于工作时M、N两个电极的质量都不减少,所以M是铁,N是石墨,溶液中OH-放电,所以其电极反应式是4 OH- - 4 e- = O2 ↑ + 2H2O,则乙池中总的反应式是4AgNO3+2H2O 4Ag+ O2↑+4HNO3。由于原电池中电解质溶液显碱性,所以负极的电极反应式是CH4-8e-+10OH-= CO32-+7H2O 。
4Ag+ O2↑+4HNO3。由于原电池中电解质溶液显碱性,所以负极的电极反应式是CH4-8e-+10OH-= CO32-+7H2O 。
(2)4.32g银的物质的量是0.04mol,则转移电子是0.04mol。所以根据电子的得失守恒可知,消耗0.01mol氧气,标准状况下的途径是0.224L。根据乙池中的总反应式可知,此时生成硝酸是0.04mol,所以氢离子的浓度是0.04mol÷0.4L=0.1mol/L。
本题难度:一般