时间:2020-08-13 06:55:53
1、简答题 10℃时加热NaHCO3饱和溶液,测得该溶液的PH发生如下变化:
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ PH 8.3 8.4 8.5 8.8 |
2、选择题 H2A是二元弱酸,KHA溶液呈酸性。在0.1mol·L-1 KHA溶液中,下列关系正确的是( )
A.c(K+)+c(H+)=c(HA-)+c(OH-)+c(A2-)? B.c(HA-)+c(A2-)=0.1mol·L-1
C.c(A2-)>c(H2A)? D.c(K+)=c(H2A)+c(HA-)+c(A2-)
3、选择题 Fe(NO3)2溶液呈浅绿色,其中存在下列平衡:Fe2+ +2H2O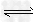 Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是?
Fe(OH)2+2H+,往该溶液中逐滴加入盐酸,发生的变化是?
[? ]
A、因为增大了H+的浓度,导致平衡逆移,所以Fe2+的浓度增大 ?
B、平衡正向移动?
C、溶液颜色由浅绿色变黄色?
D、生成红褐色沉淀
4、选择题 0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Cl-)>c(Na+)>c(OH-)>c(H+)
D.c(Na+)=c(Cl-)>c(OH-)>c(H+)
5、选择题 有一种酸式盐AHB,它的水溶液呈弱碱性。则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB====A++HB-,HB- H++B2-
H++B2-
其中错误选项的组合是(? )
A.①②
B.③④
C.②③
D.①④