时间:2020-08-13 06:42:50
1、填空题 二甲醚是一种重要的清洁燃料,可替代氟利昂作制冷剂,对臭氧层无破坏作用。工业上可利用水煤气合成二甲醚,其反应为:3H2(g)+3CO(g)  ?CH3OCH3(g)+CO2(g)? ΔH<0
?CH3OCH3(g)+CO2(g)? ΔH<0
(1)在一定条件下的密闭容器中,该反应达到平衡后,只改变一个条件能同时提高反应速率和CO的转化率的是________(填字母代号,下同)。
a.降低温度 ? b.加入催化剂
c.缩小容器体积? d.减少CO2的浓度
(2)若反应在体积恒定的密闭容器中进行,下列能判断反应已达平衡状态的是________
a.3V正(CO2)=V逆(CO)? b.生成a mol CO2的同时消耗3a mol H2
c.气体的密度不再改变?d.混合气体的平均相对分子质量不变
(3)300℃时,在体积为2L的容器中充入4 mol H2、6 mol CO。5min时,反应恰好达平衡,此时H2的转化率为75%。
① 5min时V(CO)=_________mol/(L·min)。该温度下,此反应的平衡常数为:_______
② 保持温度不变,在以上已达反应平衡的容器中,将每种物质同时增加1mol,则此时平衡将_______移动(填“正向”、“逆向”、“不”)
(4).下图中,甲装置为CH3OCH3、O2、KOH三者构成的燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
① 写出甲装置中A极的电极反应式___________________________________________
② 写出乙装置中C极的电极反应式___________________________________________
③ 当有23克甲醚参加反应时,D电极的质量变化为______克。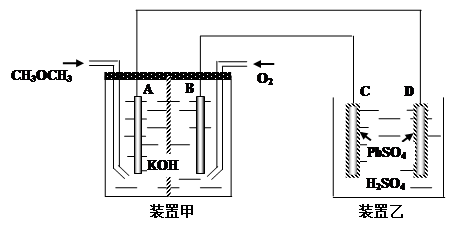
2、选择题 现有容积为1 L的甲乙两个恒温恒容密闭容器,向甲中加入2 mol A气体和2 mol B气体后发生如下反应:A(g)+B(g) C(g) △H=" -a" kJ·mol-1,反应达到平衡状态时生成1 mol C气体,放出热量Q1kJ;乙中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是(?)
C(g) △H=" -a" kJ·mol-1,反应达到平衡状态时生成1 mol C气体,放出热量Q1kJ;乙中加入1molC气体,反应达到平衡时,吸收热量Q2kJ,则Q1 与Q2的相互关系正确的是(?)
A.Q1 + Q2 = a
B.Q1 + 2Q2 < 2a
C.Q1 + 2Q2 > 2a
D.Q1 + Q2 < a
3、选择题 在容积为2L的密闭容器中,有反应:mA (g) + nB (g) pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min),C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为(?)
pC (g) + qD (g),经过5分钟达到平衡,此时各物质的变化为A减少为a mol /L,B的平均反应速率VB =" a/15" mol/ (L min),C增加2a / 3 mol/L,这时若增加系统压强,发现A与C的百分含量不变,则m:n:p:q为(?)
A.3:1:2:2
B.1:3:2:2
C.1:3:2:1
D.1:1:1:1
4、填空题 某温度时,在2 L容器中X、Y、Z三种物质随时间的变化曲线如图所示: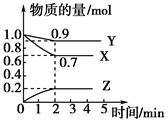
(1)由图中的数据分析,该反应的化学方程式为__________________________。
(2)反应开始至2 min时Z的平均反应速率为____________。
5、选择题 已知2NO2(g)?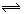 ?N2O4(g),在体积都为V的A和B两个密闭玻璃容器中,分别注入容积颜色相同的NO2和Br2(气),然后将两个容器体积同时扩大为2V,过一会儿可以看到
?N2O4(g),在体积都为V的A和B两个密闭玻璃容器中,分别注入容积颜色相同的NO2和Br2(气),然后将两个容器体积同时扩大为2V,过一会儿可以看到
A.A中颜色比B中浅? ? B.A中颜色比B中深
C.A、B中颜色深浅一样? D.A、B中颜色都比开始时深