时间:2020-08-13 06:22:52
1、选择题 设NA为阿伏伽德罗常数的值。下列说法正确的是
A.200 mL1 mol Al2(SO4)3溶液中,Al3+和SO42—离子数的总和为NA
B.标准状况下,2.24 L乙醇中含有的C—H键数目为0.5NA
C.0.1 mol Na完全被氧化生成Na2O2,转移电子的数目为0.1NA
D.0.1 mol O2和O3的混合气体中含氧原子数目为0.2NA
参考答案:C
本题解析:A.硫酸铝是强酸弱碱盐,Al3+水解导致Al3+和SO42—离子数的总和小于NA,A项错误;B.在标准状况下,乙醇是液体,无法计算物质的量,B项错误;C.Na是活泼金属,在化学反应中失去1个电子,所以0.1 mol Na完全被氧化生成Na2O2,转移电子的数目为0.1NA,C项正确;D.氧气是双原子分子,臭氧是3原子分子,所以0.1mol分子中含有的氧原子数无法计算,D项错误;选C。
考点:考查阿伏伽德罗常数及计算。
本题难度:一般
2、选择题 碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,恰好消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是(?)
A.35g
B.30 g
C.20 g
D.15 g
参考答案:C
本题解析:有关的化学反应方程式为: CuCO3+2HCl=CuCl2+ CO2↑+H2O. Cu2 (OH)2CO3+4HCl=2CuCl2+ CO2↑+2H2O. CuCO3 CuO+ CO2↑;Cu2 (OH)2CO3
CuO+ CO2↑;Cu2 (OH)2CO3 2CuO+ CO2↑+H2O.溶解固体时最后得到的是CuCl2。n(Cu)="1/2n(HCl)=1/2×1mol/L×0.5L=0.25mol." 若是灼烧等质量的上述混合物,得到氧化铜的物质的量与上述的相同。n(CuO)="n(Cu)=" 0.25mol.所以m(CuO)= n(CuO)·M=0.25mol×80g/mol=20g.所以正确选项为:C。
2CuO+ CO2↑+H2O.溶解固体时最后得到的是CuCl2。n(Cu)="1/2n(HCl)=1/2×1mol/L×0.5L=0.25mol." 若是灼烧等质量的上述混合物,得到氧化铜的物质的量与上述的相同。n(CuO)="n(Cu)=" 0.25mol.所以m(CuO)= n(CuO)·M=0.25mol×80g/mol=20g.所以正确选项为:C。
本题难度:一般
3、选择题 含有1mol HNO3的稀硝酸分别与不同物质的量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是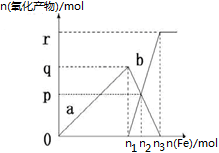
A.a是Fe(NO3)2
B.n1=0.375
C.p=0.20
D.n2=0.30
参考答案:D
本题解析:向稀硝酸中加入铁粉时,发生两个过程,开始先生成Fe(NO3)3,反应方程式为:Fe+4 HNO3(稀)=Fe(NO3)3+NO↑+2H2O,根据硝酸的物质的量为1mol利用方程式可计算出生成的 Fe(NO3)3为0.25mol,所以参加反应的铁为0.25mol即n1=0.25,a为 Fe(NO3)3,故AB错误;C选项,Fe(NO3)3与过量的铁继续反应生成? Fe(NO3)2,反应方程式为:2Fe(NO3)3+Fe="3" Fe(NO3)2,P点为 Fe(NO3)3与 Fe(NO3)2物质的量相等的点,设生成的? Fe(NO3)2物质的量xmol,则利用方程式可求得x=0.15,即P=0.15,故C错误;D选项,再根据铁原子守恒,n(Fe)=n(Fe((NO3)2)+n (Fe(NO3)3),所以 n(Fe)=0.3mol即n2=0.3mol,故D正确。
本题难度:一般
4、选择题 设阿伏加德罗常数约为6.02×1023mol -1,下列叙述中正确的是
A.常温下,4.4g CO2和N2O混合物中所含有的原子数约为0.3×6.02×1023
B.足量的锌与一定量的浓硫酸充分反应,放出2.24L气体时,转移电子数约为0.2×6.02×1023
C.标准状况下,2.24L乙烷中含有的非极性键数约为0.7×6.02×1023
D.含1mol硅原子的SiO2晶体中Si—O键的个数约为2×6.02×1023
参考答案:A
本题解析:CO2和N2O的摩尔质量均为44 g/mol,且两者的分子均为三原子分子,故A正确;B选项未指明标准状况;C选项,一个乙烷分子中只有一根非极性键,故标准状况下2.24L乙烷中含有的非极性键数约为0.1×6.02×1023;D选项,含1mol硅原子的SiO2晶体中Si—O键的个数约为4×6.02×1023
本题难度:一般
5、计算题 3.84 g Fe和Fe2O3的混合物溶于过量盐酸中,生成0.03 mol H2,反应后的溶液中加入KSCN溶液检验,溶液不显红色。求原混合物中Fe2O3的质量。
参考答案:1.6g
本题解析:最终溶液中加KSCN溶液不显红色说明其中不含Fe3+,溶质为FeCl2。总反应可表示为Fe+Fe2O3+HCl→FeCl2+H2↑+H2O,设铁的质量为x,由得失电子相等得: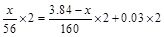 ,解得:x=2.24g。
,解得:x=2.24g。
点评:有关氧化还原反应的计算运用得失电子相等计算可快速解题。
本题难度:一般