时间:2020-08-13 06:22:52
1、选择题 设NA为阿伏伽德罗常数的值。下列说法正确的是
A.200 mL1 mol Al2(SO4)3溶液中,Al3+和SO42—离子数的总和为NA
B.标准状况下,2.24 L乙醇中含有的C—H键数目为0.5NA
C.0.1 mol Na完全被氧化生成Na2O2,转移电子的数目为0.1NA
D.0.1 mol O2和O3的混合气体中含氧原子数目为0.2NA
2、选择题 碳酸铜和碱式碳酸铜均可溶于盐酸,转化为氯化铜。在高温下这两种化合物均能分解成氧化铜。溶解28.4g上述混合物,恰好消耗1mol/L盐酸500mL。灼烧等质量的上述混合物,得到氧化铜的质量是(?)
A.35g
B.30 g
C.20 g
D.15 g
3、选择题 含有1mol HNO3的稀硝酸分别与不同物质的量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示(已知稀硝酸的还原产物只有NO)。下列有关判断正确的是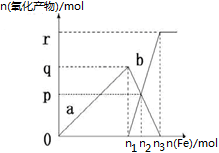
A.a是Fe(NO3)2
B.n1=0.375
C.p=0.20
D.n2=0.30
4、选择题 设阿伏加德罗常数约为6.02×1023mol -1,下列叙述中正确的是
A.常温下,4.4g CO2和N2O混合物中所含有的原子数约为0.3×6.02×1023
B.足量的锌与一定量的浓硫酸充分反应,放出2.24L气体时,转移电子数约为0.2×6.02×1023
C.标准状况下,2.24L乙烷中含有的非极性键数约为0.7×6.02×1023
D.含1mol硅原子的SiO2晶体中Si—O键的个数约为2×6.02×1023
5、计算题 3.84 g Fe和Fe2O3的混合物溶于过量盐酸中,生成0.03 mol H2,反应后的溶液中加入KSCN溶液检验,溶液不显红色。求原混合物中Fe2O3的质量。