时间:2020-08-13 06:22:52
1、选择题 摩尔是( )
A.国际单位制的一个基本物理
B.计量微观粒子的物质的量的单位
C.表示物质质量的单位
D.表示6.02×1023个粒子的集体
参考答案:B
本题解析:
本题难度:简单
2、实验题 (9分)下图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
(1)该浓盐酸的物质的量浓度为___________mol/L。
(2)某学生欲用上述浓盐酸和蒸馏水配制250 mL物质的量浓度为0.7 mol/L稀盐酸。
①该学生用量筒量取________ mL上述浓盐酸进行配制;
②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有 。
③下列操作导致所配制的稀盐酸的物质的量浓度偏低的是 (填字母)。
A.用量筒量取浓盐酸时俯视凹液面
B.未恢复到室温就将溶液注入容量瓶并进行定容
C.容量瓶用蒸馏水洗后未干燥
D.定容时仰视液面
E、未洗涤烧杯和玻璃棒
(3)若在标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为 mol/L。
a.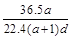 b.
b.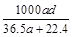 c.
c.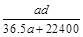 d.
d.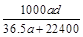
参考答案:(9分)(1)12(2分);
(2)① 14.6(2分);② 250 mL容量瓶(1分);③ A、D、E(2分,没选全1分,选错不给分);
(3)d(2分)
本题解析:(1)根据物质的量浓度与质量分数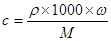 的换算关系可知:
的换算关系可知: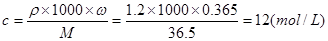 ;(2)①溶液在稀释前后溶质的物质的量不变,所以根据稀释公式C1?V1=C2?V2可知要配制250 mL物质的量浓度为0.7 mol/L稀盐酸,需要12mol/L的浓盐酸的体积是(250 mL×0.7 mol/L)÷12mol/L=14.6ml。②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有250 mL容量瓶;③A、用量筒量取浓盐酸时俯视凹液面,则盐酸的体积偏小,使配制的溶液的浓度偏低,正确;B、未恢复到室温就将溶液注入容量瓶并进行定容,则等恢复至室温时溶液的体积小于250 mL,使配制的溶液的浓度偏高,错误;C、容量瓶用蒸馏水洗后未干燥,则只要加入水至刻度线即可,因此不会产生任何影响,错误;D、定容时仰视液面,则溶液的体积偏大,使所配溶液的浓度偏低,正确;E、未洗涤烧杯和玻璃棒,则会使一部分溶质残留在容器上,容量瓶中的溶质的物质的量偏少,则使所配溶液的浓度偏低,正确。故选项是A、D、E。(3)a L标准状况下HCl气体的物质的量是a/22.4mol,质量是m(HCll)=(a/22.4)mol×36.5g/mol=(36.5a/22.4)g,溶液的质量是m(溶液)= =[(36.5a/22.4)+1000]g,溶液中溶质的质量分数是:(36.5a/22.4)/ [(36.5a/22.4)+1000]。在根据溶质的质量分数与溶液的物质的量浓度关系式可得
;(2)①溶液在稀释前后溶质的物质的量不变,所以根据稀释公式C1?V1=C2?V2可知要配制250 mL物质的量浓度为0.7 mol/L稀盐酸,需要12mol/L的浓盐酸的体积是(250 mL×0.7 mol/L)÷12mol/L=14.6ml。②所需的实验仪器有:①胶头滴管、②烧杯、③量筒、④玻璃棒,配制稀盐酸时,还缺少的仪器有250 mL容量瓶;③A、用量筒量取浓盐酸时俯视凹液面,则盐酸的体积偏小,使配制的溶液的浓度偏低,正确;B、未恢复到室温就将溶液注入容量瓶并进行定容,则等恢复至室温时溶液的体积小于250 mL,使配制的溶液的浓度偏高,错误;C、容量瓶用蒸馏水洗后未干燥,则只要加入水至刻度线即可,因此不会产生任何影响,错误;D、定容时仰视液面,则溶液的体积偏大,使所配溶液的浓度偏低,正确;E、未洗涤烧杯和玻璃棒,则会使一部分溶质残留在容器上,容量瓶中的溶质的物质的量偏少,则使所配溶液的浓度偏低,正确。故选项是A、D、E。(3)a L标准状况下HCl气体的物质的量是a/22.4mol,质量是m(HCll)=(a/22.4)mol×36.5g/mol=(36.5a/22.4)g,溶液的质量是m(溶液)= =[(36.5a/22.4)+1000]g,溶液中溶质的质量分数是:(36.5a/22.4)/ [(36.5a/22.4)+1000]。在根据溶质的质量分数与溶液的物质的量浓度关系式可得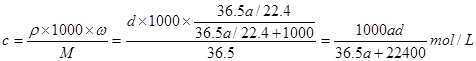 ,所以选项是d
,所以选项是d
考点:考查物质的量浓度的溶液的配制、溶液的质量分数与溶液的物质的量浓度的换算的知识。
本题难度:一般
3、选择题 用NA表示阿伏加德罗常数,1mol SO2分子中含有氧原子数为
A.NA
B.2NA
C.3NA
D.4NA
参考答案:B
本题解析:1个二氧化硫分子中含有2个O原子,所以1mol二氧化硫分子中含有2molO原子,1mol任何粒子数都是NA,所以2molO原子数目即为2NA,答案选B。
考点:考查阿伏伽德罗常数的应用
本题难度:一般
4、选择题 将20?mL?0.5?mol/L?Al2(SO4)3溶液加水稀释到500?mL,稀释后溶液中SO42-浓度为( )
A.0.01?mol/L
B.0.02?mol/L
C.0.03mol/L
D.0.06mol/L
参考答案:0.5?mol/L?Al2(SO4)3溶液中c(SO42-)=0.5mol/L×3=1.5mol/L,
令稀释后SO42-的浓度为a,根据稀释定律则:
20mL×1.5mol/L=500mL×a
解得:a=0.06mol/L,
故选D.
本题解析:
本题难度:一般
5、简答题 配制0.1mol/L氢氧化钠溶液450mL,请按操作顺序[①、②、③…]填写在操作前的括号内,并在横线上填写适当的仪器名称,操作方法或数字.
______在盛有氢氧化钠的烧杯中注入一定的蒸馏水,用玻璃棒搅拌,使其溶解.
______待溶解的氢氧化钠溶液冷却后,沿玻璃棒注入______?mL的容量瓶中.
______用天平称取氢氧化钠______?克,放入烧杯中.
______用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中.
______往容量瓶中小心加入蒸馏水至液面接近刻度______cm处,改用______?加蒸馏水.至溶液液面恰好______.
参考答案:配制0.1mol/L氢氧化钠溶液450mL的步骤为:
①计算、称量,根据所配溶液体积,选择500mL容量瓶,氢氧化钠的质量=500mL×10-3L/mL×0.1mol/L×40g/mol=2g,用天平称取氢氧化钠2克,放入烧杯中;
②溶解,在盛有氢氧化钠的烧杯中注入一定的蒸馏水,用玻璃棒搅拌,使其溶解;
③移液,将冷却后的氢氧化钠溶液,沿玻璃棒注入500mL容量瓶中;
④洗涤,用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中;
⑤定容,往容量瓶中小心加入蒸馏水至液面接近刻度1~2处,改用胶头滴管滴加,溶液液面恰好与刻度线相切.
故答案为:排序②、③、①、④、⑤;
500;2;1~2;胶头滴管;与刻度线相切.
本题解析:
本题难度:一般