时间:2020-08-13 06:17:22
1、选择题 有常温下物质的量浓度均为0.1 mol/L的①氨水②NH4Cl溶液③Na2CO3溶液?④NaHCO3溶液,下列说法正确的是(?)
A.4种溶液pH的大小顺序:①>④>③>②
B.等体积的①和②溶液混合后若pH>7:c(Cl-)>c(N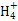 )
)
C.溶液①、③由水电离产生的c(OH-):①<③
D.溶液③、④等体积混合后,溶液中c(C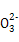 )>c(HC
)>c(HC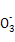 )
)
参考答案:C
本题解析:Na2CO3水解程度大于NaHCO3,碱性强,故4种溶液pH的大小顺序:①>③>④>②,A错;根据溶液电中性:c(N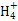 )+c(H+)=c(Cl-)+c(OH-),由溶液的pH>7,可知c(H+)<c(OH-),故c(N
)+c(H+)=c(Cl-)+c(OH-),由溶液的pH>7,可知c(H+)<c(OH-),故c(N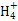 )>c(Cl-),B错;Na2CO3水解促进水的电离,NH3·H2O电离抑制水的电离,故水电离产生的c(OH-):①<③,C对;③、④等体积混合后以C
)>c(Cl-),B错;Na2CO3水解促进水的电离,NH3·H2O电离抑制水的电离,故水电离产生的c(OH-):①<③,C对;③、④等体积混合后以C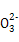 的水解为主,且C
的水解为主,且C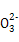 水解生成HC
水解生成HC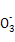 ,故溶液③、④等体积混合后,溶液中c(C
,故溶液③、④等体积混合后,溶液中c(C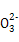 )<c(HC
)<c(HC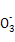 ),D错。
),D错。
本题难度:一般
2、选择题 有0.1mol?L-1的三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
A.溶液①中,c(CH3COO-)=c(H+)
B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH)=c(Na+)
D.溶液①、③等体积混合,混合液中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
参考答案:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(CH3COO-)+c(OH-)=c(H+),故A错误;
B.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,浓度越小,醋酸根离子浓度越小,所以混合液中c(CH3COO-)小于溶液③中的c(CH3COO-),故B错误;
C.溶液①、②等体积混合,二者恰好反应生成0.05mol/L的醋酸钠,溶液中存在物料守恒,根据物料守恒得c(CH3COO-)+c(CH3COOH)=c(Na+),故C正确;
D.溶液①、③等体积混合,醋酸的电离程度大于醋酸根离子水解程度,溶液呈酸性,c(H+)>c(OH-),根据电荷守恒得c(H+)+c(Na+)=c(CH3COO-)+c(OH-),所以c(Na+)<c(CH3COO-),故D错误;
故选C.
本题解析:
本题难度:简单
3、选择题 pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液(c=0.1mol/L)至pH =7,消耗NaOH溶液的体积为 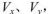 ,则
,则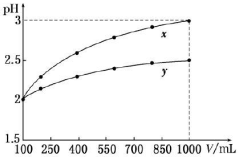
A.x为弱酸,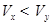
B.y为弱酸,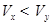
C.x为强酸,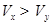
D.y为弱酸,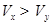
参考答案:B
本题解析:pH=2的两种一元酸x和y,体积均为100 mL,加水稀释到1000mL,稀释10倍,x酸PH=3,说明x酸是强酸,而y酸的PH值大于2,小于5,说明y酸是弱酸, 强、弱酸的PH值相同,弱酸的浓度大于强酸,与NaOH溶液反应至PH值都等于7,弱酸消耗氢氧化钠的体积大,即Vx<Vy,选B。
考点:考查弱电解质的电离平衡及PH的有关计算等知识。
本题难度:一般
4、选择题 某温度下,将pH相同的盐酸和醋酸溶液分别稀释,平衡时溶液pH随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是 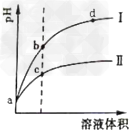
[? ]
A.曲线Ⅰ为醋酸稀释时溶液pH变化曲线
B.加入足量NaOH,b点溶液消耗的NaOH比c点溶液消耗的多
C.a点时,加入少量相同大小的锌粒,与盐酸反应的速率大
D.b点溶液中水的电离程度比c点溶液中水的电离程度大
参考答案:D
本题解析:
本题难度:一般
5、选择题 在乙酸的下列性质中,可以证明它是弱电解质的是:
A.1 mol/L乙酸溶液中c(H+)约为1×10-2 mol/L
B.乙酸能与水以任意比例互溶
C.10 mL 1 mol/L乙酸恰好跟10 mL 1 mol/L NaOH溶液完全反应
D.在相同温度下,相同浓度的乙酸的导电性比强酸 溶液的导电性弱
溶液的导电性弱
参考答案:A
本题解析:略
本题难度:一般