时间:2020-08-13 06:17:22
1、选择题 下列叙述正确的是
A.pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同
B.室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中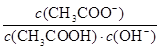 减小
减小
C.醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液后溶液呈中性则c(NH4+)=c(Cl-)
参考答案:D
本题解析:A.相同pH,则氢离子浓度相同,产生氢气的起始速率相等,反应开始后醋酸中氢离子浓度大于盐酸中氢离子浓度,错误;B.醋酸是弱酸,存在电离平衡,稀释促进电离。由于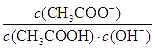 =
=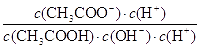 =
=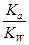 ,因为温度不变,所以
,因为温度不变,所以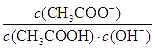 不变,错误;C.醋酸钠溶于水水解程度小是可逆反应,错误;D.根据电荷守恒可知c(NH4+) +c(H+)=c(Cl-)+c(OH-),因c(H+)=c(OH-)=10-7mol/L,所以c(NH4+)=c(Cl-),正确。
不变,错误;C.醋酸钠溶于水水解程度小是可逆反应,错误;D.根据电荷守恒可知c(NH4+) +c(H+)=c(Cl-)+c(OH-),因c(H+)=c(OH-)=10-7mol/L,所以c(NH4+)=c(Cl-),正确。
考点:考查强弱电解质,弱电解质的。
本题难度:一般
2、填空题 (12分)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在着一种定量关系:如25 ℃时,HA H++A-,则K=
H++A-,则K= ,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH H++CH3COO- | 1.75×10-5 |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S H++HS- H++HS-HS-  H++S2- H++S2- | K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
参考答案:(1)变大 (2)K值越大,酸性越强 (3)H3PO4 HS- (4)当多元弱酸电离出1个H+后,便带一个单位负电荷,再电离时相当于在负电荷的束缚下电离出带正电荷的H+,故越来越难电离,K越来越小 (5) K1?K2?K3
本题解析: (1)弱酸的电离是吸热反应,升高温度促进弱酸电离,所以电离平衡常数增大,故答案为:增大;
(2)同一温度下,酸的电离常数越大其电离程度越大,则酸性越强,故答案为:Ka值越大酸性越强;
(3)同一温度下,酸的电离常数越大其酸性越强,根据酸的电离常数知,酸性最强的是H3PO4,最弱的是HPO42-,故答案为:H3PO4;HPO42-;
(4)产生相同离子时抑制电解质的电离,多元弱酸电离时上一级电离产生的H+对下一级电离有抑制作用,所以其电离常数逐渐减小,故答案为:上一级电离产生的H+对下一级电离有抑制作用.
考点:弱电解质的电离平衡。
本题难度:一般
3、选择题 下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中:
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:
C.1.0mol Na2CO3溶液中:
Na2CO3溶液中:
D.某二元弱酸的酸式盐NaHA溶液中:
参考答案:C
本题解析:A、NH4HCO3中NH4+与HCO3?发生相互促进的水解,NH4+水解程度增大,NH4HSO4电离出H+,抑制NH4+的水解,NH4+水解程度减小,所以c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中:c(NH4HCO3) >c(NH4Cl) >c(NH4HSO4),错误;B、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液,说明醋酸的电离大于醋酸钠的水解,CH3COO?浓度增大,所以c(CH3COO?) >c(Na+),错误;C、根据质子守恒,H2O电离出的H+总量等于OH?的总量,所以 ,正确;D、根据电荷守恒,正电荷总数等于负电荷总数,所以c(Na+)+c(H+)=c(OH?)+c(HA-)+2c(A2-),错误。
,正确;D、根据电荷守恒,正电荷总数等于负电荷总数,所以c(Na+)+c(H+)=c(OH?)+c(HA-)+2c(A2-),错误。
本题难度:一般
4、简答题 (22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。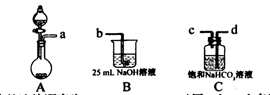
①各装置正确的连接顺序为?(用a、b、c、d表示)。
②检查整套装置气密性的方法是?。
③装置A中常用药品为?;装置C中化学药品的作用是?。
(2)写出步骤三中发生反应的离子方程式?。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法?。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下: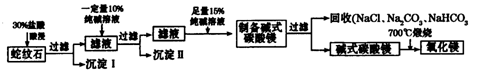
(1)过滤需要的玻璃仪器有?。
(2)沉淀Ⅱ的成分为?,请用离子方程式表示生成沉淀的过程?(写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为?。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____?,
参考答案:I.(1)①a d
d c
c b。②关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③稀盐酸和大理石;除去二氧化碳中的氯化氢。(2)OH-+HCO3—====CO32—+H2O。(3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
b。②关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③稀盐酸和大理石;除去二氧化碳中的氯化氢。(2)OH-+HCO3—====CO32—+H2O。(3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
Ⅱ.(1)烧杯、漏斗、玻璃棒。(2)根据上述分析知,沉淀Ⅱ的成分为CaCO3、Fe(OH)3、Al(OH)3,CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;(3)c(Na+)>c(CO32—)>c(OH-)>c(HCO3—)>c(H+)。(4)1 mo1·L-1。
本题解析:I.根据题意知,该小组制备碳酸钠溶液的原理为:CO2(过量)+NaOH====NaHCO3,NaOH+NaHCO3====Na2CO3+H2O。(1)分析题给装置知,A为二氧化碳的发生装置,B中发生二氧化碳与氢氧化钠溶液的反应,C装置除去二氧化碳中的氯化氢;①为制得纯净的碳酸氢钠溶液,要先除去二氧化碳中的氯化氢,各装置正确的连接顺序为a d
d c
c b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。?(2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。?(3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
b。②检查整套装置气密性的方法是关闭分液漏斗活塞,向烧杯中加水至没过导管口,微热烧瓶,导管口有气泡冒出,停止加热,导管内形成一段水柱,说明装置气密性良好。③实验室制备二氧化碳的原理为碳酸钙和稀盐酸反应,装置A中常用药品为稀盐酸和大理石;装置C中化学药品的作用是除去二氧化碳中的氯化氢。?(2)步骤三中发生反应的离子方程式为OH-+HCO3—====CO32—+H2O。?(3)步骤二的目的为除去溶解的过量的二氧化碳,否则将使碳酸钠不纯。
Ⅱ.根据题给流程分析,蛇纹石用30%盐酸酸浸,MgO、CaO、Fe2O3、Al2O3和盐酸反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,CaO+2HCl=CaCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O;而SiO2不与盐酸反应,过滤得沉淀Ⅰ为二氧化硅,滤液为MgCl2、CaCl2、FeCl3、AlCl3和盐酸的混合液,向滤液中加入一定量10%纯碱溶液,Ca2+、Fe3+、Al3+和碳酸钠溶液反应转化为氢氧化铁、氢氧化铝和碳酸钙沉淀经过滤而除去,反应方程式为CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;向滤液中加足量15%纯碱溶液制得碱式碳酸镁,过滤,回收氯化钠、碳酸钠和碳酸氢钠,碱式碳酸镁煅烧得氧化镁。(1)过滤需要的玻璃仪器有烧杯、漏斗、玻璃棒。(2)根据上述分析知,沉淀Ⅱ的成分为CaCO3、Fe(OH)3、Al(OH)3,用离子方程式表示生成沉淀的过程CO32- + Ca2+====CaCO3↓,2Fe3+ + 3CO32- + 3H2O ="===" 2Fe(OH)3↓ + 3CO2↑,2Al3+ + 3CO32- + 3H2O====2Al(OH)3↓ + 3CO2↑;(3)纯碱溶液中所有离子浓度的大小关系为c(Na+)>c(CO32—)>c(OH-)>c(HCO3—)>c(H+)。(4)利用公式c=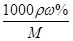 ?将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
?将题给数据代入计算,纯碱溶液的物质的量浓度为1 mo1·L-1。
本题难度:一般
5、选择题 下列说法不正确的是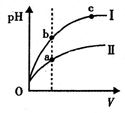
A.等物质的量浓度的NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a 的代数式表示NH3·H2O的电离常数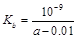
C.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如上图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
D.已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生
参考答案:D
本题解析:A项等物质的量浓度的 NH4HSO4溶液和NaOH溶液等体积混合,反应后溶液溶质为(NH4)2SO4、Na2SO4等物质的量混合液,NH4+水解溶液呈酸性,故溶液中离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-),A项正确;B项25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),则溶液中c(H+)=c(OH-)=10-7mol/L,故NH3·H2O的电离常数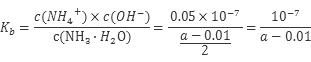 ,B项正确;C项为某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,由曲线可知曲线Ⅰ 稀释PH变化大,故曲线Ⅰ 为盐酸稀释曲线,曲线Ⅱ为醋酸稀释曲线,a点PH值小,对水的抑制程度大,故a、b两点水的电离程度:a<b,故C项正确;D项已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,由电离常数可知酸性:H2CO3>HCN>HCO3—,故据此可推测将氢氰酸加入到碳酸钠溶液中只能生成HCO3—,不能生成二氧化碳,故不会观察到有气泡产生,D项错误,本题选D。
,B项正确;C项为某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线,由曲线可知曲线Ⅰ 稀释PH变化大,故曲线Ⅰ 为盐酸稀释曲线,曲线Ⅱ为醋酸稀释曲线,a点PH值小,对水的抑制程度大,故a、b两点水的电离程度:a<b,故C项正确;D项已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,由电离常数可知酸性:H2CO3>HCN>HCO3—,故据此可推测将氢氰酸加入到碳酸钠溶液中只能生成HCO3—,不能生成二氧化碳,故不会观察到有气泡产生,D项错误,本题选D。
考点:溶液中平衡离子关系。
本题难度:困难