时间:2020-08-13 06:17:22
1、选择题 下列叙述正确的是
A.pH相等的盐酸和醋酸溶液中分别加入足量相同的Zn片,反应过程中生成氢气的速率始终相同
B.室温下向10mL pH=3的醋酸溶液中加水稀释后,溶液中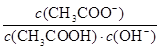 减小
减小
C.醋酸钠溶液中存在反应:CH3COONa+H2O=CH3COOH+NaOH
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液后溶液呈中性则c(NH4+)=c(Cl-)
2、填空题 (12分)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在着一种定量关系:如25 ℃时,HA H++A-,则K=
H++A-,则K=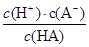 ,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
,式中K为电离平衡常数,只与温度有关,c为平衡浓度。下表是几种弱酸的电离平衡常数(25 ℃)。
| 酸 | 电离方程式 | 电离平衡常数K |
| CH3COOH | CH3COOH H++CH3COO- | 1.75×10-5 |
| H2CO3 | H2CO3 H++HCO3- H++HCO3-HCO3-  H++CO32- H++CO32- | K1=4.4×10-7 K2=4.7×10-11 |
| H2S | H2S H++HS- H++HS-HS-  H++S2- H++S2- | K1=1.3×10-7 K2=7.1×10-15 |
| H3PO4 | H3PO4 H++H2PO4- H++H2PO4-H2PO4-  H++HPO42- H++HPO42-HPO42-  H++PO43- H++PO43- | K1=7.1×10-3 K2=6.3×10-8 K3=4.2×10-13 |
3、选择题 下列溶液中有关物质的浓度关系正确的是
A.c(NH4+)相等的NH4HCO3、NH4HSO4、NH4Cl溶液中:
B.向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液中:
C.1.0mol Na2CO3溶液中:
Na2CO3溶液中:
D.某二元弱酸的酸式盐NaHA溶液中:
4、简答题 (22分)研究碳及其化合物的性质和用途是中学化学的任务之一。
I.某兴趣小组在实验室中制备碳酸钠溶液。方案如下:步骤一,取25 mL一定浓度的NaOH溶液,通人CO2气体至过量;步骤二,加热煮沸步骤一所得溶液;步骤三,另取25 mL相同浓度的NaOH溶液与步骤二所得溶液混合,即得碳酸钠溶液。
(1)完成步骤一可选的化学试剂有:稀盐酸、NaOH溶液、大理石、饱和碳酸钠溶液、稀硫酸、饱和碳酸氢钠溶液等,需要的装置如下所示。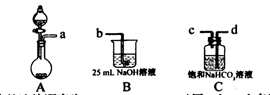
①各装置正确的连接顺序为?(用a、b、c、d表示)。
②检查整套装置气密性的方法是?。
③装置A中常用药品为?;装置C中化学药品的作用是?。
(2)写出步骤三中发生反应的离子方程式?。
(3)有同学提出“步骤二”没有必要,请你简述自己的看法?。
Ⅱ.实验室用纯碱和盐酸处理某种蛇纹石(已知蛇纹石中含有MgO、SiO2.CaO、Fe2O3、Al2O3等氧化物)模拟制备氧化镁的流程如下: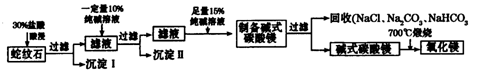
(1)过滤需要的玻璃仪器有?。
(2)沉淀Ⅱ的成分为?,请用离子方程式表示生成沉淀的过程?(写出一个即可)。
(3)纯碱溶液中所有离子浓度的大小关系为?。
(4)已知l0%的纯碱溶液密度为1.06g/cm3,则其物质的量浓度为____?,
5、选择题 下列说法不正确的是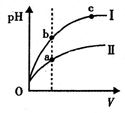
A.等物质的量浓度的NH4HSO4溶液和NaOH溶液等体积混合,溶液中各离子浓度大小关系为:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-)
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a 的代数式表示NH3·H2O的电离常数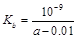
C.某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如上图所示。II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b
D.已知298K时氢氰酸(HCN)的Ka=4.9×10-10、碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中能观察到有气泡产生