时间:2020-08-13 06:06:21
1、选择题 根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g)△H=-297.23kJ/mol分析下列说法中正确的是( )
A.1mol?S燃烧放出的热量为297.23kJ
B.S(g)+O2(g)=SO2(g)?放出的热量大于297.23kJ
C.S(s)+O2(g)=SO2(s)?放出的热量小于297.23kJ
D.形成1mol?SO2的化学键释放的能量小于断裂1mol?S(s)?和1mol?O2(g)?的化学键所吸收的能量
2、简答题 乙醇是重要的化工原料和液体燃料,可以利用下列反应制取乙醇:
2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g)
(1)写出该反应的平衡常数表达式:K=______.
(2)请说明以CO2为原料合成乙醇的优点是______(只要求写出一条).
(3)在一定压强下,测得该反应的实验数据如下表:
| 温度/℃CO2转化率/% n(H2)/n(CO2) | 500 | 600 | 700 | 800 1.5 45 33 20 12 2.0 60 43 28 15 3.0 83 62 37 22 |

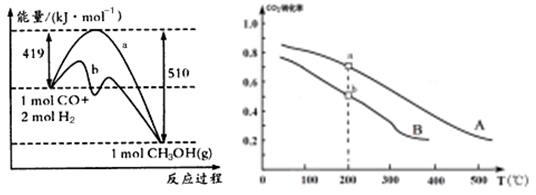
3、填空题 (4分)工业上常用天然气作为制备甲醇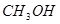 的原料。已知:
的原料。已知:
①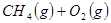
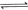
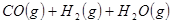
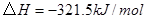
②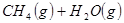
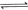
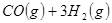
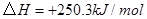
③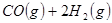
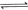
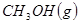
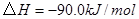
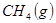 与
与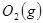 反应生成
反应生成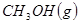 的热化学方程式为 。
的热化学方程式为 。
(2)向VL恒容密闭容器中充入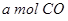 与
与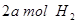 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。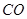 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示: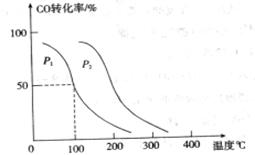
①压强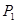
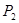 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在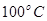 、
、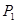 压强时,平衡常数为 (用含
压强时,平衡常数为 (用含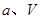 的代数式表示)。
的代数式表示)。
4、填空题 过度排放CO2会造成“温室效应”,科学家正在研究如何将CO2转化为可利用的
资源。目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,
在1 L固定体积的密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH>0,经测得CO2和CH3OH(g)的浓度随时间变化如图所示。
(1)从反应开始到平衡,CO2的平均反应速率v(CO2)= ;
(2)该反应的平衡常数表达式K= ;
(3)能判断该反应是否达到化学平衡状态的依据是 (多选扣分);
a.容器中压强不变 b.v正(H2)=v逆(H2O)
c.混合气体中c(H2O)不变 d.c(CO2)=c(CH3OH)
(4)下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
a.升高温度 b.将CH3OH(g)及时液化抽出
c.选择高效催化剂 d.再充入H2O(g)
5、填空题 (15分)(1)已知在常温常压下:
① 2CH3OH(l)+3O2(g) 2CO2(g)+4H2O(g) △H=" -1275.6" kJ·mol-1
② H2O(l) H2O(g) △H=" +" 44.0 kJ.mol-1
写出表示甲醇燃烧热的热化学方程式 。
(2)甲醇是一种重要的化工原料,又是一种可再生能源,具有开发和应用的广阔前景。
| 方法一 | CO(g) +2H2(g) 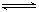 CH3OH(g) CH3OH(g) |
| 方法二 | CO2(g) +3H2(g) 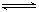 CH3OH(g) +H2O(g) CH3OH(g) +H2O(g) |