时间:2020-08-13 06:06:21
1、填空题 依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为_______________________________。
(2)若适量的N2和O2完全反应,每生成23g NO2需要吸收16.95kJ热量
____________________________。
(3)已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为_____________________________。
参考答案:(1)CH3OH(l)+3/2O2(g)→CO2(g)+2H2O(l) ΔH=-725.76kJ·mol-1
(2)N2(g)+2O2(g) === 2NO2(g) ΔH=+67.8kJ·mol-1
(3)N2(g)+3H2(g) === 2NH3(g) ΔH=-92kJ·mol-1
本题解析:
本题难度:一般
2、选择题 下列热化学方程式或说法正确的是
[? ]
A.甲烷的燃烧热为△H=-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+
2H2O(g) △H=-890 kJ/mol
B.500℃、30MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)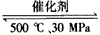 2NH3(g) △H=-38.6 kJ/mol
2NH3(g) △H=-38.6 kJ/mol
C.已知:H2(g)+F2(g)=2HF(g) △H= -270 kJ/mol,则1mol氢气与1 mol氟气反应生成2 mol液态氟化氢放出的热量小于270 kJ
D.在C中相同条件下,2 mol HF气体的能量小于1 mol 氢气与1mol氟气的能量总和
参考答案:D
本题解析:
本题难度:简单
3、填空题 (1)已知:2SO2(g)+O2(g)?2SO3?(g)△H=-196.6kJ?mol-1;2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1 .则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=______kJ?mol-1
一定条件下,将NO2与SO2?按体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是______.
a.体系压强保持不
b.混合气体颜色保持不变
c.SO3与NO的体积比保持不变
d.每消耗1mol SO3的同时生成1mol NO2
(2)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).CO在不同温度下的平衡转化率与压强的关系如图1所示.该反应△H______0(填“>”或“<”).实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是______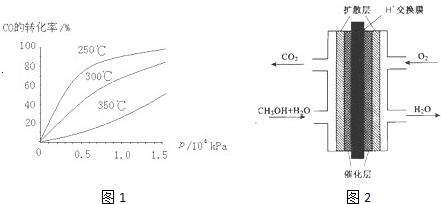
(3)甲醇(CH3OH)燃料电池的结构示意图如图2.甲醇进入______极(填“正”或“负”),正极发生的电极反应为______.
(4)101kPa时,若16gCH3OH完全燃烧生成液态水,放出热量为363.25kJ/mol,则甲醇燃烧的热化学方程式为______.
参考答案:(1)根据盖斯定律,将第二个方程式颠倒过来,与第一个方程式相加得:2NO2+2SO2═2SO3+2NO,△H=-83.6 kJ?mol-1,则NO2+SO2?SO3+NO,△H=-41.8 kJ?mol-1;
a、本反应是反应前后气体分子数不变的反应,故体系的压强保持不变,故a不能说明反应已达到平衡状态;
b、随着反应的进行,NO2的浓度减小,颜色变浅,故b可以说明反应已达平衡;
c、SO3和NO都是生成物,比例保持1:1,故c不能作为平衡状态的判断依据;
d、d中所述的两个速率都是逆反应速率,不能作为平衡状态的判断依据;故选b;
故答案为:-41.8;b;
(2)由图可知,温度升高,CO的转化率降低,平衡向逆反应方向移动,故逆反应是吸热反应,正反应是放热反应,△H<0;压强大,有利于加快反应速率,有利于使平衡正向移动,但压强过大,需要的动力大,对设备的要求也高,故选择250℃、1.3×104kPa左右的条件.因为在250℃、压强为1.3×104 kPa时,CO的转化率已较大,再增大压强,CO的转化率变化不大,没有必要再增大压强,
故答案为:<;在1.3×104kPa下,CO的转化率已较高,再增大压强CO的转化率提高不大,而生产成本增加得不偿失;
(3)甲醇燃料电池中,甲醇中C元素的化合价升高,则甲醇为负极,电解质为酸,甲醇失去电子生成二氧化碳,电极反应为CH3OH+H2O-6e-=CO2+6H+,氧气再正极上得到电子发生还原反应在酸溶液中生成水,反应的电极反应为:O2+4H++4e-═2H2O,
故答案为:负;?O2+4H++4e-═2H2O;
(4)101kPa时,若16gCH3OH物质的量为0.5mol,完全燃烧生成液态水,放出热量为363.25kJ/mol,则1mol甲醇燃烧放热726.5KJ;反应的热化学方程式为:CH3OH(l)+3/2?O2(g)═CO2(g)+2H2O(l)△H=-726.5?kJ/mol,
故答案为:CH3OH(l)+3/2 O2(g)═CO2(g)+2H2O(l)△H=-726.5 kJ/mol.
本题解析:
本题难度:一般
4、选择题 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ·mol-1
下列说法正确的是
[? ]
A.CH3OH的反应热不仅与各物质的状态有关,也与参加反应的反应物的量有关
B.CH3OH蒸气的燃烧热大于676.7kJ·mol-1
C.CH3OH转变成H2的过程只能是一个从高能量到低能量的过程
D.根据①推知反应:CO2(g)+3H2(g)=CH3OH(l)+H2O(g) 的△H<-49.0kJ·mol-1
参考答案:BD
本题解析:
本题难度:一般
5、选择题 国际石油价格多次上涨,为解决能源危机,多省市推广使用乙醇汽油作为发动机燃料,即在汽油中掺入一定比例的乙醇,以代替一部分汽油。已知热化学方程式:1/2C2H5OH(l)+ 3/2O2(g)=CO2(g)+3/2H2O(l)△H=-683.4kJ/mol。下列有关说法正确的是
[? ]
A.乙醇汽油是一种清洁能源,燃烧不会产生任何污染
B.在25℃、101kPa时,生成1mol水时放出683.4kJ的热量
C.乙醇的燃烧热为1366.8kJ/mol
D.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g) △H=-1366.8kJ/mol
参考答案:C
本题解析:
本题难度:一般