时间:2020-08-13 06:04:59
1、选择题 下列有关溶度积常数Ksp的说法正确的是
A.常温下,向BaCO3饱和溶液中加入Na2CO3固体,BaCO3的Ksp减小
B.溶度积常数Ksp只受温度影响,温度升高Ksp减小
C.溶度积常数Ksp只受温度影响,温度升高Ksp增大
D.常温下,向Mg(OH)2饱和溶液中加入NaOH固体,Mg(OH)2的Ksp不变
参考答案:D
本题解析:Ksp像其它常数一样,只与温度有关,对大多数难溶解电解质来说,温度升高,平衡向正向移动,Ksp增大,但也有减少的,A、B、C都错;答案选D。
本题难度:一般
2、填空题 对于一个化学反应的研究需要从反应条件、限度、速率、定量关系等因素进行综合分析,下列是关于化学反应的系列研究,请根据相关信息回答问题。
⑴关于反应物之间的定量关系的研究:
已知反 应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为?
应:Br2 +2Fe2+=2 Br -+2Fe3+,向10 mL0 .1mol/L的Fe Br2溶液中通入0 .003mol Cl2,该反应的离子方程式为?
⑵关于反应速率、限度的研究:
①已知298K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,在氯化镁溶液中加入一定量的烧碱,测得pH=13.0,则此温度下残留在溶液中的c(Mg 2+)=?
②科学研究发 现纳米级的Cu2O可作为太阳光分解水的催化剂。
现纳米级的Cu2O可作为太阳光分解水的催化剂。
一定温度下 ,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应:
,在2L密闭容器中加入纳米级的Cu2O并通入0 .1mol水蒸气,发生反应: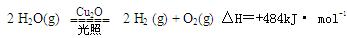 2 H2O(g) ?
2 H2O(g) ?
2 H2(g) + O2(g)△H=+484kJ· mol-1,不同时段产生O2的量见下表:
| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

参考答案:
本题解析:略
本题难度:一般
3、填空题 (15分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:
A.连接好仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C.将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2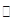 SO2 +2Cu。
SO2 +2Cu。
F.移取25.00mL含SO2的水溶液于250mL锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为?,当产生_______________________________的现象时可判断滴定已经达到终点。
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
参考答案:
(1)除去空气中的还原性气体与酸性气体?(2分)
干燥空气?(2分)
(2)2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O?(2分)
滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色 (2分)
(3)80%?(2分)
(4)在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低?(2分)
(5)4 ×10-3mol/L ?(2分)
本题解析:
(1)装置①的作用是:除去空气中的还原性气体与酸性气体;装置②的作用是:干燥空气。
(2)2KMnO4+5H2SO3=2MnSO4+K2SO4+2H2SO4+3H2O?滴入最后一滴标准KMnO4溶液后,溶液由无色变为淡紫色,并在半分钟内不褪色
(3)高锰酸钾三次的次的用量分别为:19.99 mL、20.01 mL、18.04 mL,第三组数据有明显的误差,可以舍去不用,前两次的的平均值为:20.00mL
2KMnO4---------------------5H2SO3--------------------5 SO2------------- 5Cu2S
?2? 5
0.0100mol/L×20.00mL? X
解之得:X=5×10-4 mol
那么辉铜矿样品中Cu2S的质量分数是:w(Cu2S)=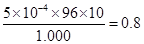
(4)在KMnO4滴定前,未反应完的O2与空气中的O2也可将H2SO3氧化,造成测定结果偏低?
(5)Ksp(FeS)=c(Fe2+)·c(S2-)= 6 . 25 × 10 -18?
当溶液中(Fe2+)为1 mol/L时,c(S2-)=6 . 25 × 10 -18?mol/L,
应调节溶液的c(H十)为:c2(H+)=
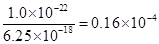
c (H+)= 4 ×10-3mol/L? 考点:
考点:
本题难度:一般
4、简答题 取一支洁净试管,向试管中加入0.1mol?L-1AgNO3溶液2mL,再向硝酸银溶液中加入稍过量的铜粉,反应足够长时间后,取上层清液于另一支试管中,再向该试管中滴加0.1mol?L-1KI溶液.回答有关上述实验的下列问题:
(1)可判断硝酸银溶液和铜的反应(正向反应)已确实发生的现象是______.
(2)可判断硝酸银溶液和铜的反应的逆反应也同时发生的现象是______.
(3)实验中若将KI溶液换成KCl溶液,则可能出现什么不同的现象?______.
参考答案:(1)Cu+2AgNO3=Cu(NO3)2+2Ag,AgNO3溶液是无色的,反应发生后,生成物中有铜离子,铜离子在水溶液中的颜色是蓝色的,如果已经反应,无色溶液会变成蓝色,所以可判断硝酸银溶液和铜的反应(正向反应)已确实发生的现象是溶液中出现淡蓝色,故答案为:溶液中出现淡蓝色;
?(2)AgNO3+KI=AgI↓+KNO3 ,AgNO3和KI 反应生成不溶于水的黄色AgI沉淀,如果向上清液中加入碘化钾出现黄色沉淀,就证明上清液中有AgNO3 ,以此可判断硝酸银溶液和铜的反应的逆反应也同时发生,故答案为:上层清液中加入碘化钾出现黄色沉淀;
(3)AgNO3+KCl=AgCl↓+KNO3 ,AgCl是不溶于水的白色沉淀,所以实验中若将KI溶液换成KCl溶液,则可能出现白色沉淀,故答案为:出现白色沉淀.
本题解析:
本题难度:一般
5、选择题 已知Ca(OH)2的溶解度随温度升高而降低。将某温度下饱和澄清石灰水①加入少量生石灰后恢复到原来温度;②降低温度。这两种情况下,前后均保持不变的是
A.溶液的质量
B.Ca(OH)2的溶解度
C.溶液中Ca2+离子的数目
D.溶液中溶质的质量分数
参考答案:D
本题解析:略
本题难度:一般