时间:2020-08-13 05:43:04
1、选择题 A+、B+、C+、D-四种离子两两组成四种可溶性盐,其中:AC和BD盐溶液PH=7,BC盐溶液PH>7,则下列说法正确的是
A.AD盐溶液PH<7
B.在AC盐溶液中C(A+)+C(AOH)=C(C-)+C(HC)
C.碱的电离程度一定是:AOH>BOH
D.酸的电离程度一定是:HD>HC
参考答案:C
本题解析:
本题难度:困难
2、选择题 在0.1 mol/L的NaHS溶液中有关微粒浓度的关系正确的是
A.c(Na+)>c(HS-)>c(S2-)>c(H+)>c(OH-)
B.c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+)
C.c(Na+)=c(HS-)+c(S2-)+c(OH-)
D.c(Na+)=c(HS-)+c(S2-)+c(H2S)
参考答案:D
本题解析:
本题难度:困难
3、选择题 下列应用中与盐类水解无关的是
[ ? ]
A.明矾净水
B.实验室配制FeCl3溶液时加入少量稀盐酸
C.使用热的纯碱溶液去除油污
D.实验室制H2时加入CuSO4可提高反应速率
参考答案:D
本题解析:
本题难度:简单
4、选择题 在溶液中不能发生水解的离子是
A.HS-
B.CO32-
C.Fe3+
D.Br-
参考答案:D
本题解析:
本题难度:简单
5、选择题 下列变化不属于盐类水解反应的是
[? ]
①NH3+H2O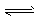 NH4++OH-
NH4++OH-
②HCO3-+H2O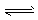 H2CO3+OH-
H2CO3+OH-
③HCO3-+H2O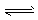 H3O++CO32-
H3O++CO32-
④Al3++3HCO3-== Al(OH)3↓+3CO2↑
⑤AlO2-+HCO3-+H2O==Al(OH)3↓+CO32-
⑥NH4++ 2H2O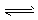 NH3·H2O+H3O+
NH3·H2O+H3O+
A.①③⑤
B.②③⑤
C.①④⑤
D.①③
参考答案:B
本题解析:
本题难度:一般